小鼠尾静脉注射方法-小卫星可变重复序列 PCR
简介
小卫星可变重复序列 PCR,1 号染色体长臂(lq42〜43)的小卫星 MS32 即 D1S8 位点的等位基因内部含有碱基数目相同但序列不同的两种重复单位,其差别在于重复序列 3'端第二个碱基 G 突变为碱基 A,导致产生或消除 HaeⅢ的酶切位点,利用 PCR 技术分别扩增这两种重复单位,电泳分离并用数字编码其排列图谱,从而获得数字化的遗传信息,该方法被称作数字编码的小卫星可变重复序列 PCR 。MVR-PCR 具有 高灵敏度、高识别能力,尤其适合法医学中 DNA 多态性分析的需要。
原理
小卫星可变重复序列 PCR 的基本原理是,以 Jeffreys 最初建立的 MS32 位点的 MVR-PCR 分析为例。MS32 位点由 29 个核苷酸的重复单位串联形成,重复单位有两种类型:a 型和 t 型,a 型含有 HaeⅢ酶切位点,t 型由于该酶切位点中的 G→A 的碱基突变而不能被 HaeⅢ切割。针对这些重复单位的特点,设计 4 种引物:①TAG-A,是自 HaeⅢ切点起与 a 型重复单位互补的寡核苷酸链,在 5』端又接上 1 段由 20 个核苷酸构成的不能与模板互补的 TAG 顺序,其作用是防止 MVR 的两种特异性引物在 PCR 产物内部引导扩增而产生进行性 PCR 产物的缩短;②TAG-T,它与引物 TAG-A 只相差 1 个碱基,是一段与 t 型重复单位互补的顺序,也接上同样的 TAG 顺序;③引物 TAG,它与 TAG-A 中的 TAG 顺序相同,只能与扩增后链中的 TAG 顺序退火(图 13-1); ④引物 32D 则选用小卫星 DNA 邻近的一段序列,其序列如下:5'-CGACTCGCAGATGGAGCAATGGCC-3',或选用与重复序列更加邻近的一段顺序 32O,其序列为 5'-GAGTAGTTTGGTGGGAAGGGTGGTT-3』。

将样品分为 2 组:A 组和 T 组。加入 TAG 引物和 32D 引物后,分别加入 TAG-A 和 TAG-T 引物。TAG-A 和 TAG-T 作为下游引物单向扩增模板 DNA,获得带有 TAG 末端的扩增产物。32D 引物作为上游引物以带有 TAG 末端的扩增产物为模板进行 PCR 扩增产生带有 TAG 和 32D 末端的扩增产物。最后在 32D 和 TAG 引物作用下,扩增获得 A/T 型重复单位到 32D 区域的 PCR 产物群(图 13-2)。
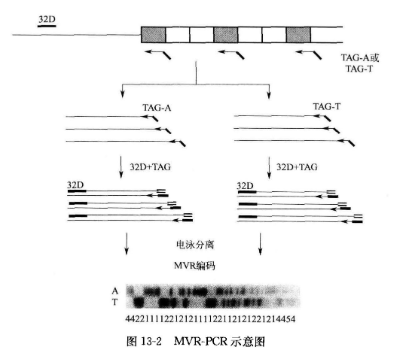
当将 A、T 两组 PCR 产物经电泳分离后,将结果叠加,根据 Jeffreys 的编码原则,MVR 图谱中表现出 3 种重复单位:a 型在 A 行中出现带(在高加索人群中占 72.9%); t 型在 T 行中出现带(占 25.5%);。型在 A、T 行均无带。原因可能是重复单位内没有与 a 型或 t 型特异性引物相匹配的序列,这种概率很小,仅为 1.6%。样品基因组 DNA 的图谱是 A 行和 T 行谱带叠加的结果。根据叠加结果中带的强弱和有无分成 6 种等位基因,并分别用数字 1〜6 来表示。纯合子 中仅出现 1,2,6 三型。每个数字编码表示 1 个重复单元,含有相当丰富的信息量。
材料与仪器
器材:PCR 热循环仪、核酸电泳仪、凝胶成像设备、离心机等。
试剂:
PCR 所用材料:DNA 模板提取试剂盒(针对不同的模板有不同的提取方式,因此应选择不同的试剂)、引物、 Taq 酶、三磷酸脱氧核甘酸(dNTP)和反应缓冲液。
步骤
小卫星可变重复序列 PCR 的基本过程可分为如下几步:(一)DNA 模板的制备
1. 样品来源MVR-PCR 多应用于人类遗传学研究和法医学的 DNA 分析。其样品来源多样,一般用于人类遗传学分析的样品多为釆集的血样;而进行法医学检定的样品则为与犯罪有关的人体组织、体 液、分泌物、毛发、骨组织、精斑、唾液等物证。这些物证应依不同的种类和性质,按法医学标准程序提取、包装及保存。2.DNA 提取方法的选择选择何种基因组 DNA 提取方法应根据具体样品与 DNA 的后处理而定。最常用并且技术成 熟的 DNA 提取方法是酚-氯仿抽提法,该方法对样品用蛋白酶 K 进行消化处理,用酚-氯仿反复抽提获得 DNA;此外还有使用 NP-40、Triton X-100 的无酚提取法以及硅珠吸附法等。 不论釆用何种方法,均应简化操作步骤,缩短提取过程以减少 DNA 的降解,特别是毛发、精 斑、血痕等样品量很少而且核酸极易降解的法医学检材。在对法医学检定的样品进行 DNA 制备时,应根据不同样品的各自特点进行一些必要的预处理,以提高 DNA 的产率;同时也应注意对 DNA 进行纯化,以避免这些预处理对 PCR 反应可能的抑制作用,例如骨骼样品的核酸提取,在进行脱钙预处理后,可能会残留影响 PCR 反应的钙离子,应将制备的 DNA 进行纯化,或者在提取过程中将钙离子去除。DNA 提取也可直接使用现成的基因组 DNA 提取试剂盒,例如 QIAGEN 公司的 QIAamp®基因组 DNA 提取试剂盒系列,该系列针对从临床样品如血液及相关产品、毛发、精液及各种组织 中分离基因组 DNA。使用试剂盒获得的基因组 DNA 量与纯度更高,并且操作方便快捷。下面介绍最常用的酚-氯仿抽提法,其它的基因组提取方法,如甲酰胺解聚法、异丙醇沉淀法、Chelex100 抽提法、NP40 裂解法、Triton X-100 裂解抽提法、硅珠抽提法,可参看相应文献;各种基因组 DNA 提取试剂盒使用方法可参看相应试剂盒手册。3. 酚氯仿抽提法(1) 样品的处理①组织:取 1〜20 mg 动物组织,去除结缔组织和残血后,移入预冷的研钵中,用力快速研 磨成匀浆。如果是富含 DNA 酶的胰脏、脾脏,或者富含胶原蛋白的皮肤、肌腱等组织,以及坚 硬的骨骼等,应在研磨中反复添加液氮,直至将组织研磨成粉末状。加入 600 风细胞裂解缓冲液 [10 mmol/L Tris-HCl (pH8. 0), 100 mmol/L NaCl, Immol/L EDTA (pH8. 0)], 继续研磨 lmin, 将组织匀浆转移到 1. 5 ml 离心管中。注意:进行液氮操作时,需小心操作防止冻伤。如果处理的样品为有害生物材料,例如含有致病菌等, 则应按相应等级生物安全操作规程进行,并对器械和废弃物进行处理。②细胞:收集 5×106 个数目的细胞,用 PBS 磷酸盐缓冲液或者生理盐水漂洗 2 次。用 600μl 细胞裂解缓冲液悬浮。③血液:将 1 mL 新鲜抗凝血,1300 g 离心 15 min, 弃上清 (血浆),将淡黄色下层小心移至新的离心管中,加双蒸水洗细胞 2 次,弃上清。如果是冻存血液,将血液室温解冻后,加入等体积 PBS 混匀,3500 g 离心 15 min, 弃上清。用 600μl 细胞裂解缓冲液悬浮白细胞。注意:全血中唯一含有细胞核可用于制备基因组 DNA 的血细胞为白细胞,仅占总量的 0.3%。一般正 常人的白细胞数目为 107 个/mL 血液,但有些病人血中白细胞数目可能是这个的 10 倍,因此如果使用试剂 盒从病人全血中制备基因组 DNA 时,需要减少血液样品的体积以免超过提取体系的承受范围。此外采血液标本时,应注意从静脉血与动脉血提取的 DNA 的量会有所不同。(2)DNA 的提取在 600μl 体系中,加入 60μl SDS (100 g/L) 和 10μl 蛋白酶 K (10 μg/mL)。37°C 过夜或者 56°C 保温 4 h (保温过程中,应不时轻轻摇匀反应液) 裂解细胞,消化蛋白。将反应液冷却至 4°C, 加等体积 Tris 饱和酚 (pH8.0), 充分混匀,4°C10000 g 离心 10 min, 吸取上层黏稠水相移至另一离心管。加等体积 Tris 饱和酚 (pH8.0),重复一次 Tris 饱和酚抽提。吸取上层水相,加等体积氯仿-异戊醇 (24:1, 体积比),充分混匀,4°C10000 g 离心 5 min。吸取上层溶液移至另一离心管。重复一次氯仿-异戊醇抽提。吸取上层溶液至 2.5 倍体积冷 95% 乙醇中,轻摇至 DNA 析出。离心弃上清,用 70% 冷乙醇清洗 3〜4 次。加适量 TE 溶液 [10 mmol/L Tris-HCl, lmmol/L EDTA (pH8. 0)] 或者去离子水溶解 DNA。(二)MVR-PCR
1.MVR 位点与相应引物设计目前已发现的 MVR 位点有 D1S8(MS32),D7S21(MS31A), D16S309(MS2O5),MSY1(DYF155Sl)g 等。设计 MVR-PCR 引物时,应根据研究目的和方法的不同设计相应的引 物(表 13-1)。表 13-1 已应用的 MVR-PCR 引物| MVR 位点 | 引物 |
| D1S8(MS32) | 32D: 5'-CGACTCGCAGATGGAGCAATGGCC-3』32-TAG-A/T:3'tcatgcgtccatggtccggaCATTCTGAGTCACCCCTGGCC/T) -5'TAG: 3'-tcatgcgtccatggtccgga -5' |
| D7S21(MS31A) | 31-Alu 1+/-, 31 -Psp14061 + /—, Hga I +/-31-TAG-A/G, TAG31A; 5'-CCCTTTGCACGCTGGACGGTGGCG-3'31A-A/T: 5'-AGTGTCTGTGGGAGGTGG(A/G)-3' |
| MSY1(DYF1S5S1) | Y1A: 5'-ACAGAGGTAGATGCTGAAGCGGTATAGC -3'TAG1/3: 5'-tcatgcgtccatggtccggaTGTGTATAATATACAT C/G ATGTATATTG -3'Y1B: 5'-GCAACTCAAGCTAGGACAAAGGGAAAGG -3'TAG3R/4R: 5' - tcatgcgtccatggtccggaCATCATGTATATTATACA C/T AATATACATC-3' |
(三)MVR 图谱的数字编码
将获得的 MVR 图谱上的 A 与 T 的结果叠加,根据 MVR 数字编码原则进行编码,即可得到 特异的 MVR 编码。MVR-PCR 的 6 级数字编码原则如表 13-2 所示。表 13-2 MVR-PCR 的 6 级数字编码| 编码 | MVR PCR 电泳谱带特征 | |
| A 行 | T 行 | |
| l(aa) | 强 | 无 |
| 2(tt) | 无 | 强 |
| 3(at) | 弱 | 弱 |
| 4(a0) | 弱 | 无 |
| 5(t0) | 无 | 弱 |
| 6(00) | 无 | 无 |
| 编码 | MVR-PCR 电泳谱带特征 | |
| A 行 | T 行 | |
| 1(10) | 有 | 无 |
| 2(01) | 无 | 有 |
| 3(11) | 有 | 有 |
| 6(00) | 无 | 无 |




