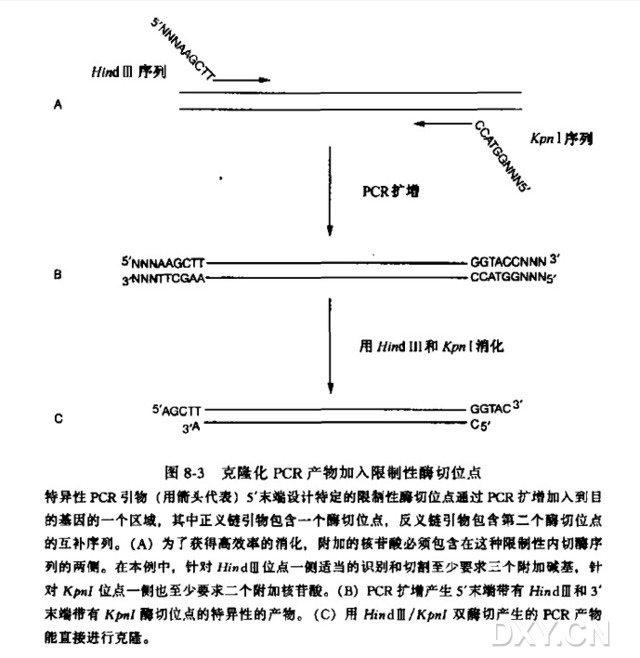
应用 PCR 的遗传工程
原理本方案(由德克萨斯大学西南医学中心的 Andereson 提供)叙述在克隆化的哺乳动物 cDNA 的 5‘ 与 3‘ 端同时导入限制性内切核
原理
本方案(由德克萨斯大学西南医学中心的 Andereson 提供)叙述在克隆化的哺乳动物 cDNA 的 5' 与 3' 端同时导入限制性内切核酸酶酶切位点,有时在此 cDNA 5' 末端,改变部分密码子为大肠杆菌的偏爱密码子等。
材料与仪器
限制性内切核酸酶 热稳定 DNA 聚合酶 阳性对照 DNA 模板 DNA
扩增缓冲液 dNTP 贮存液
琼脂糖凝胶或聚丙烯酰胺凝胶 屏蔽型枪头 离心管或微量滴定板正向排液式移液器 PCR 仪
扩增缓冲液 dNTP 贮存液
琼脂糖凝胶或聚丙烯酰胺凝胶 屏蔽型枪头 离心管或微量滴定板正向排液式移液器 PCR 仪
步骤
一、材料
1. 缓冲液和溶液
10X 扩增缓冲液
4 种 dNTP 贮存液(20 mmol/L, pH 8.0)
2. 酶与缓冲液
合适的限制性内切核酸酶
热稳定 DNA 聚合酶
3. 凝胶
琼脂糖凝胶或聚丙烯酰胺凝胶
4. 核苷酸与寡聚核苷酸
寡核苷酸引物 1 与引物 2 均溶于 TE ( 10 μmol/L, pH 8.0)
阳性对照 DNA
模板 DNA
5. 载体
质粒 DNA 应用相应的限制性内切核酸酶消化和凝胶电泳纯化
6. 特殊设备
自动微量移液器的屏蔽型枪头
离心管(0.5 ml, 薄壁扩增反应专用离心管)或微量滴定板
正向排液式移液器
PCR 仪
二、方法
1. 设计与合成预期的末端修改的寡核苷酸引物。
例如,根据 cDNA 模板设计的 5'引物为 5' dATCATATGGCTCTG GATGAACT- GTGCCTGCTGGACATGCT3',3' 引物为 5' dATAAGCTTTTATTAAGACA-GACTCAGCTCATGGGAGGCAA3',这样在 cDNA 的 5' 末端引入了 Nde I (CATATG) 位点,改变了 cDNA 的部分密码子为大肠杆菌偏爱密码子。下面划线的核苷酸表示寡核苷酸引物与 cDNA 模板之间是不同的。对于寡核苷酸引物 3' 末端完全配对的碱基对数目究竟是要求多少对才能成功扩增靶基因尚无精确定论;然而,具体工作中发现一般有 8~10 对完全配对的碱基对就足够了。
2. 按以下次序,将各成分加入在 0.5 ml 灭菌离心管,扩增管或灭菌滴定板的孔内,混合:
100 ng 模板 DNA 10 μl
10X 扩增缓冲液 5 μl
20 mmol/L 4 种 dNTP 混合液 5 μl
10 μmol/L 引物 1 ( 50 pmol ) 5 μl
10 μmol/L 引物 2 ( 50 pmol ) 5 μl
1~2 单位热稳定 DNA 聚合酶 1 μl
H2O 补足至 50 μl
设置二支对照反应管,加入以上除了模板 DNA 的所有试剂。在其他反应中,加 入包含模板 DNA 的所有以上试剂。通过 PCR 预期会产生阳性结果。试验管与对照管一同进行所有后续的实验步骤。
3. 如果 PCR 仪没有配制加热盖,在反应混合液的上层应加一滴矿物油(约 50 μl),防止样品在 PCR 反应多个加热与冷却的循环过程中蒸发。如果应用热启动 PCR 程序,在反应混合液的上层加一层石蜡油。放置离心管和微量滴定板在 PCR 仪上。
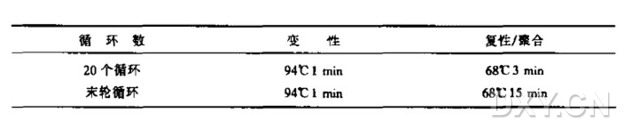
4. 按以下方法进行 PCR 扩增。典型的程序有变性、复性和聚合(延伸反应);相应的循环条件与温度列表如下:
5. 抽取每种扩增样品 5%~10%, 用琼脂糖凝胶电泳或聚丙烯酰胺凝胶电泳来分析扩增结果,用 DNA marker 来判断扩增片段的大小。凝胶一般用 EB ( 溴化乙锭)或 SYBR 金颗粒染色后来观察扩增的量与片段大小。
—次成功的扩增反应应该产生与我们预期大小一致的 DNA 片段。扩增条带可用 DNA 序列分析,SoutKem 杂交和限制性内切核酸酶酶切图谱予以鉴定。
6. 若用矿物油覆盖在微量离心管内样品液体的上层(步骤 3),反应结束后可用 150 μl 氯仿抽提去除。
7. 为了后续的克隆,对 DNA 扩增片段应用相应的限制性内切核酸酶进行消化(酶切位点由引物的 5' 末端导入,上述例子应用 NdeⅠ和 HindⅢ)。应用凝胶电泳或超滤方法纯化酶解片段。
8. 用预期的载体 DNA 建立适当的连接反应,连接反应中插入片段与载体的摩尔比率为 3:1。
1. 缓冲液和溶液
10X 扩增缓冲液
4 种 dNTP 贮存液(20 mmol/L, pH 8.0)
2. 酶与缓冲液
合适的限制性内切核酸酶
热稳定 DNA 聚合酶
3. 凝胶
琼脂糖凝胶或聚丙烯酰胺凝胶
4. 核苷酸与寡聚核苷酸
寡核苷酸引物 1 与引物 2 均溶于 TE ( 10 μmol/L, pH 8.0)
阳性对照 DNA
模板 DNA
5. 载体
质粒 DNA 应用相应的限制性内切核酸酶消化和凝胶电泳纯化
6. 特殊设备
自动微量移液器的屏蔽型枪头
离心管(0.5 ml, 薄壁扩增反应专用离心管)或微量滴定板
正向排液式移液器
PCR 仪
二、方法
1. 设计与合成预期的末端修改的寡核苷酸引物。
例如,根据 cDNA 模板设计的 5'引物为 5' dATCATATGGCTCTG GATGAACT- GTGCCTGCTGGACATGCT3',3' 引物为 5' dATAAGCTTTTATTAAGACA-GACTCAGCTCATGGGAGGCAA3',这样在 cDNA 的 5' 末端引入了 Nde I (CATATG) 位点,改变了 cDNA 的部分密码子为大肠杆菌偏爱密码子。下面划线的核苷酸表示寡核苷酸引物与 cDNA 模板之间是不同的。对于寡核苷酸引物 3' 末端完全配对的碱基对数目究竟是要求多少对才能成功扩增靶基因尚无精确定论;然而,具体工作中发现一般有 8~10 对完全配对的碱基对就足够了。
2. 按以下次序,将各成分加入在 0.5 ml 灭菌离心管,扩增管或灭菌滴定板的孔内,混合:
100 ng 模板 DNA 10 μl
10X 扩增缓冲液 5 μl
20 mmol/L 4 种 dNTP 混合液 5 μl
10 μmol/L 引物 1 ( 50 pmol ) 5 μl
10 μmol/L 引物 2 ( 50 pmol ) 5 μl
1~2 单位热稳定 DNA 聚合酶 1 μl
H2O 补足至 50 μl
设置二支对照反应管,加入以上除了模板 DNA 的所有试剂。在其他反应中,加 入包含模板 DNA 的所有以上试剂。通过 PCR 预期会产生阳性结果。试验管与对照管一同进行所有后续的实验步骤。
3. 如果 PCR 仪没有配制加热盖,在反应混合液的上层应加一滴矿物油(约 50 μl),防止样品在 PCR 反应多个加热与冷却的循环过程中蒸发。如果应用热启动 PCR 程序,在反应混合液的上层加一层石蜡油。放置离心管和微量滴定板在 PCR 仪上。
4. 按以下方法进行 PCR 扩增。典型的程序有变性、复性和聚合(延伸反应);相应的循环条件与温度列表如下:

5. 抽取每种扩增样品 5%~10%, 用琼脂糖凝胶电泳或聚丙烯酰胺凝胶电泳来分析扩增结果,用 DNA marker 来判断扩增片段的大小。凝胶一般用 EB ( 溴化乙锭)或 SYBR 金颗粒染色后来观察扩增的量与片段大小。
—次成功的扩增反应应该产生与我们预期大小一致的 DNA 片段。扩增条带可用 DNA 序列分析,SoutKem 杂交和限制性内切核酸酶酶切图谱予以鉴定。
6. 若用矿物油覆盖在微量离心管内样品液体的上层(步骤 3),反应结束后可用 150 μl 氯仿抽提去除。
7. 为了后续的克隆,对 DNA 扩增片段应用相应的限制性内切核酸酶进行消化(酶切位点由引物的 5' 末端导入,上述例子应用 NdeⅠ和 HindⅢ)。应用凝胶电泳或超滤方法纯化酶解片段。
8. 用预期的载体 DNA 建立适当的连接反应,连接反应中插入片段与载体的摩尔比率为 3:1。
相关文章
- RT-PCR、Western blot和ELISA三者的区别
- PCR反应五要素
- 原位聚合酶链式反应(in situ PCR)和原位反转录聚合酶链式反应(in situ RT-PCR)操作规程
- A sensitive quantification of HHV-6B by real-time PCR
- PCR标准反应体系
- Validation of RNAi by Real Time PCR
- Site-Directed Mutagenesis and Gene Fusion by Megaprimer PCR
- 逆转录-聚合酶链反应 (Reverse Transcription-Polymerase Chain Reaction,RT-PCR
- 锚定PCR
- Real-Time PCR Fluorescent Chemistries