循环测序:利用 PCR 和引物末端标记进行双脱氧测序实验
材料与仪器ddNTP 延伸 终止混合物 酶及其缓冲液 AmpliTaq CS 或其他无外切酶活性的 DNA 聚合酶 循环测序缓冲液 热稳定的 DNA 聚合酶 核
材料与仪器
ddNTP 延伸 终止混合物 酶及其缓冲液 AmpliTaq CS 或其他无外切酶活性的 DNA 聚合酶 循环测序缓冲液 热稳定的 DNA 聚合酶 核酸和寡核苷酸 模板 DNA
小离心管 或者微孔板 热循环仪
小离心管 或者微孔板 热循环仪
步骤
材料
溶液和缓冲液
贮存液、缓冲液和试剂的配方请参照附录 1。
将贮存液稀释到适当的浓度。
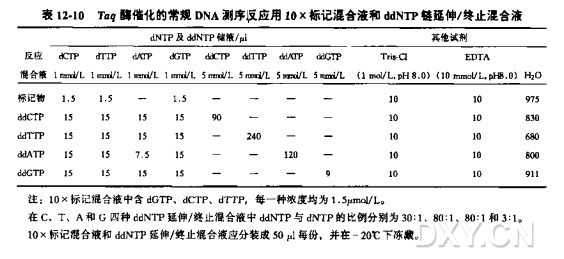
ddNTP 延伸/终止混合物
ddNTP 溶液:四种 ddNTPs, 各 5.0 mmol/L
dNTP 溶液:四种 dNTPs, 各 1.0 mmol/L
EDTA(0.05mol/L,pH8.0)
甲酰胺上样缓冲液
Tris-Cl(1mol/L,pH8.0)
酶及其缓冲液
AmpliTaq CS 或其他无外切酶活性的 DNA 聚合酶(5units/ul)。
5X 循环测序缓冲液
200 mmol/LTris-Cl(pH8.8)
25 mmol/LMgCl2
热稳定的 DNA 聚合酶
选择酶时,请参照本章介绍中及方法 5 中表 12-19 的介绍选择测序系统。该方法依据 AmpliTaqCS 写出. 但其他类似的热稳定酶同样可用。
核酸和寡核苷酸
寡核苷酸引物,5'端由 33P 或 32P 放射性标记
请见第 10 章,方案 2。
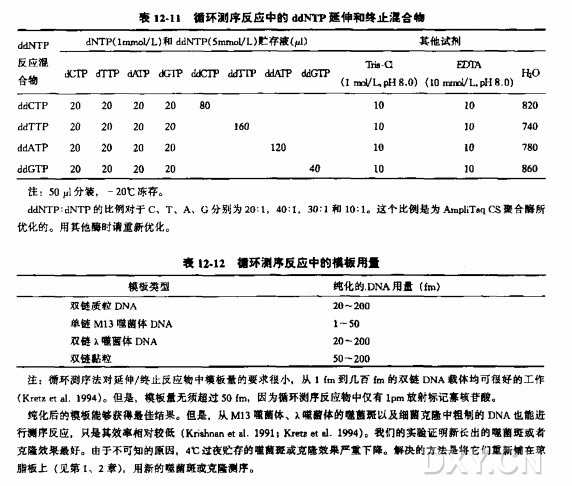
模板 DNA
质粒、黏粒、λ噬菌体和噬菌体 M13DNA 以及通过第 1~4 章中任何方法得到的 DNA 都可以用作模板。表 12-12 表明了每种摸板的需要量(同时参考表 12-4)。
特殊装置
小离心管(0.5 ml) 或者微孔扳(柔软,热稳定,96 个 300ul 溶剂 U 型孔)
这些板可被标记以不同彩色和/或标上 C、T、A 和 G 字样。
设计好的热循环程序(见步骤 5)。
方法
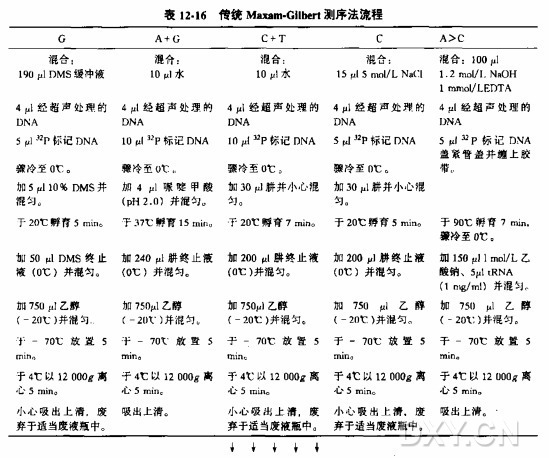
1.将每一种ddNTP混合物(参考表12-11)各4ul放入相应的0.5ml离心管或微孔板中。置于冰上。
2.在每管/孔中加人:
双链DNA模板 10~100fm
1.5pmoles 5'端由32P放射性标记的引物 1.0ul
5X循环测序缓冲液 2.0ul
加水 至5.0ul
~undefined如果使用33P末端标记的引物:使用5pm标准制备的由33P放射性标记的寡核苷酸(参见附录方法:使用PCR和[a-32P]dNTP内部标记进行的循环测序反应为保证测序混合物的化学计量。可在不增加反应体积的情况下将DNA量增加3倍(30—300fm)。
3.在1X循环测序缓冲液中将AmpliTaq CS聚合酶溶解至0.5~1.0U/ul。将1ul溶解好的酶溶液加入孔或管中。
4.轻弹管壁或摇动微孔板使物质混合。如果需要,在反应上加一滴矿物油,盖上管盖,2000r/m离心2s。确认矿物油未被紫外线照射过.否则会产生PCR的强抑制剂。
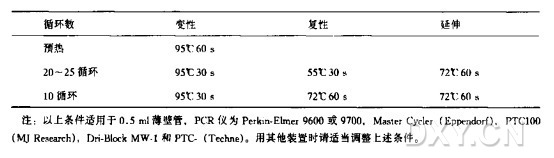
5.将管或微孔板放入PCR仪,预热到95°C。依据以下程序操作。
重要:开始程序时切勿拖延。保证在95°C预热时间不趙过3min。否则DNA聚合酶会失活。
6.取出板或管,分别加入5ul甲酰胺加样缓冲液。
7.反应物可在-20°C保存5天或直接用变性聚丙烯酰胺凝胶电泳分析(方案8,9,10,11和12)。变性后(100°C 2min),在冰上骤冷,每种反应物用3ul上样。





溶液和缓冲液
贮存液、缓冲液和试剂的配方请参照附录 1。
将贮存液稀释到适当的浓度。
ddNTP 延伸/终止混合物
ddNTP 溶液:四种 ddNTPs, 各 5.0 mmol/L
dNTP 溶液:四种 dNTPs, 各 1.0 mmol/L
EDTA(0.05mol/L,pH8.0)
甲酰胺上样缓冲液
Tris-Cl(1mol/L,pH8.0)
酶及其缓冲液
AmpliTaq CS 或其他无外切酶活性的 DNA 聚合酶(5units/ul)。
5X 循环测序缓冲液
200 mmol/LTris-Cl(pH8.8)
25 mmol/LMgCl2
热稳定的 DNA 聚合酶
选择酶时,请参照本章介绍中及方法 5 中表 12-19 的介绍选择测序系统。该方法依据 AmpliTaqCS 写出. 但其他类似的热稳定酶同样可用。
核酸和寡核苷酸
寡核苷酸引物,5'端由 33P 或 32P 放射性标记
请见第 10 章,方案 2。
模板 DNA
质粒、黏粒、λ噬菌体和噬菌体 M13DNA 以及通过第 1~4 章中任何方法得到的 DNA 都可以用作模板。表 12-12 表明了每种摸板的需要量(同时参考表 12-4)。
特殊装置
小离心管(0.5 ml) 或者微孔扳(柔软,热稳定,96 个 300ul 溶剂 U 型孔)
这些板可被标记以不同彩色和/或标上 C、T、A 和 G 字样。
设计好的热循环程序(见步骤 5)。
方法
1.将每一种ddNTP混合物(参考表12-11)各4ul放入相应的0.5ml离心管或微孔板中。置于冰上。

2.在每管/孔中加人:
双链DNA模板 10~100fm
1.5pmoles 5'端由32P放射性标记的引物 1.0ul
5X循环测序缓冲液 2.0ul
加水 至5.0ul
~undefined如果使用33P末端标记的引物:使用5pm标准制备的由33P放射性标记的寡核苷酸(参见附录方法:使用PCR和[a-32P]dNTP内部标记进行的循环测序反应为保证测序混合物的化学计量。可在不增加反应体积的情况下将DNA量增加3倍(30—300fm)。
3.在1X循环测序缓冲液中将AmpliTaq CS聚合酶溶解至0.5~1.0U/ul。将1ul溶解好的酶溶液加入孔或管中。
4.轻弹管壁或摇动微孔板使物质混合。如果需要,在反应上加一滴矿物油,盖上管盖,2000r/m离心2s。确认矿物油未被紫外线照射过.否则会产生PCR的强抑制剂。
5.将管或微孔板放入PCR仪,预热到95°C。依据以下程序操作。
重要:开始程序时切勿拖延。保证在95°C预热时间不趙过3min。否则DNA聚合酶会失活。

6.取出板或管,分别加入5ul甲酰胺加样缓冲液。
7.反应物可在-20°C保存5天或直接用变性聚丙烯酰胺凝胶电泳分析(方案8,9,10,11和12)。变性后(100°C 2min),在冰上骤冷,每种反应物用3ul上样。





相关文章
- RT-PCR、Western blot和ELISA三者的区别
- PCR反应五要素
- 原位聚合酶链式反应(in situ PCR)和原位反转录聚合酶链式反应(in situ RT-PCR)操作规程
- A sensitive quantification of HHV-6B by real-time PCR
- PCR标准反应体系
- Validation of RNAi by Real Time PCR
- Site-Directed Mutagenesis and Gene Fusion by Megaprimer PCR
- 逆转录-聚合酶链反应 (Reverse Transcription-Polymerase Chain Reaction,RT-PCR
- 锚定PCR
- Real-Time PCR Fluorescent Chemistries