很多小伙伴进入实验室后,都会或多或少的接触到流式实验,成为一个初级FLOWER看着师兄师姐动辄十几色的多色流式玩得轻车熟路,大数据分析信手拈来(什么tSNE图,FlowSOM啊等等,简直不要太Perfect),收获老板连声夸赞
然而,一出手就让人看出来Non-professional的你,难道只能在组会上默默流下羡慕的泪水?
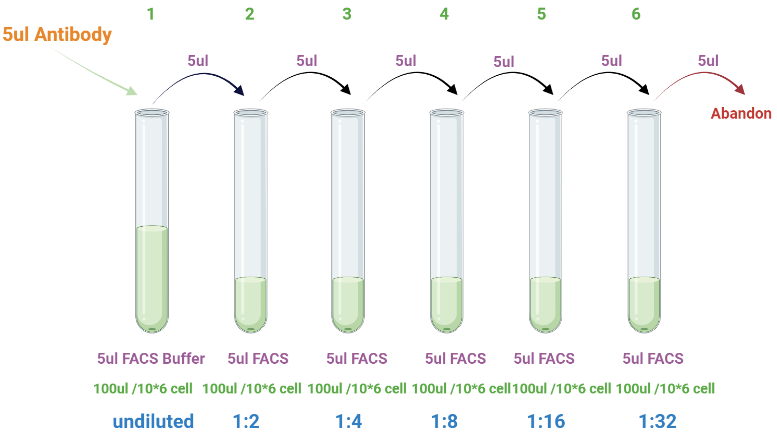
那么,为何不从今天开始打怪升级让我们从初级FLOWER变成老板的小骄傲呢?First,当我们购买到商业化的流式抗体后,(有些小伙伴可能还不会买抗体,别笑,你可能真不会买呢!买哪家的,怎么配色,怎么选克隆号等等,都有讲究。别慌,我们后续推文会你给购物指南哦)千万不要直接根据Instruction的Recommended usage 浓度直接染色啦Professional的你应该特别关注Recommended usage的最后一句It is recommended that the reagent be titrated for optimal performance for each application.图片来源:https://www.biolegend.com/因为推荐浓度一般是过饱和的,这带来了一定的抗体浪费,造成实验成本的增加但更重要的是,使用过量的抗体,也会大大提高非特异性染色,造成实验结果误差增加▲因此,为了更好的实验效果以及节省抗体的目的,抗体滴定实验,尤其在多色流式检测中就显得尤为重要就是通过倍比稀释的方法,设计不同的抗体体积梯度,检测抗体在你的实验条件下最优上样浓度(By the way,别人滴定的抗体浓度你可以直接拿来用吗?理论上如果你们染色的细胞类型相同,是可以用的)以BD公司的流式抗体为例:BD公司的流式抗体浓度一般为Concentration=0.2 mg/mL,推荐每个test检测用量为1 μg,那么最大用量即为5μL1. 准备6个1.5 mL EP管,在每个管中加入5 μL FACS buffer在1号管中加入5 μL抗体原液,混匀。换枪头,取5 μL加入下一个管中。以此类推。6号管中的最后5 μL弃去(细胞可以使用小鼠脾脏制备的PBMC,比较方便。但是最好用实验待检测的细胞滴定抗体,染色体积和细胞量也需一样)3. 4℃孵育30 min,1650 rpm离心5min,弃上清。加入200 μL FACS buffer重悬后加入PI,上机检测FACS buffer配方:在PBS中加入1% FBS和2 mM EDTA。4 ℃保存然而结果该怎样show出来呢?让老板赏心悦目的结果必然是一张美图,此时,我们就呈上一张美图!现在就打开FlowJo一起复现吧!
复现过程:
1. 打开FlowJo软件,将抗体滴定的若干个FCS数据文件拖入按照滴定抗体时的稀释比例由高到低放置FCS数据文件
3. 然后选择live cell,按ctrl+shift+E可选择同组中所有相同名称的行
4. 在File面板中,选择Export/Concatenate按钮下拉菜单Export/Concatenate Populations。填好你滴定抗体的名称(如CD8)后,点击concatenate
5. 点击右下角的Concatenate,新建一个NEW Workspace
6. 然后就能出图啦!打开新数据里面Live cell门事件,然后纵坐标选择CD8(本次滴定抗体名称)、横坐标选择SampleID,即可在一个散点图中展示各个滴定数据中CD8的分群变化了,一目了然看出滴定结果如上图所示:在我们的实验条件下选择1:4或1:8的抗体稀释比较为合适★小编个人经验:BD或Biolegend的CD3,CD4,CD8这三种流式抗体在100 μL /106体系下基本都是1:8的稀释比(小鼠脾脏,淋巴结,外周血,肿瘤组织等等都可以适用)