动物活体光学成像-常规注射方式——皮下注射、肌肉注射、静脉注射、动脉注射
原理
在动物实验中,为了观察药物对机体功能、代谢及形态引起的变化,常需要将药物注入动物体内。给药的途径和方法多种多样,可根据实验目的、实验动物种类和药物剂型、剂量等情况确定。
材料与仪器
实验动物
试剂:水、碘酒、酒精、药液
仪器耗材:注射器、金属网、针头、铁丝笼、玻璃筒、橡皮带、注射针
步骤
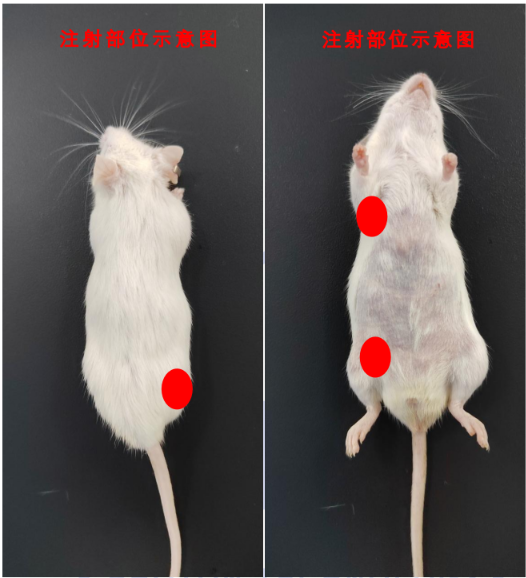
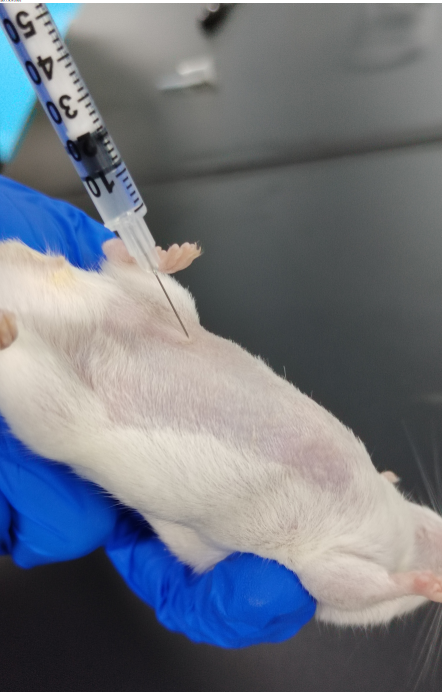
皮下注射:常选注射部位为大腿背部、大腿内存或腋下。操作时,使用碘酒或 75% 酒精消毒注射部位。针头与皮肤平行进针,刺入约 1 厘米。针头稍微左右动一下,若能动则说明在皮下,否则可能在皮内或肌肉内。轻轻回抽,若没有回血,则可缓慢注射药物。小鼠一般注射量为 100 微升。拔针时,按压进针部位,以防药物漏出。
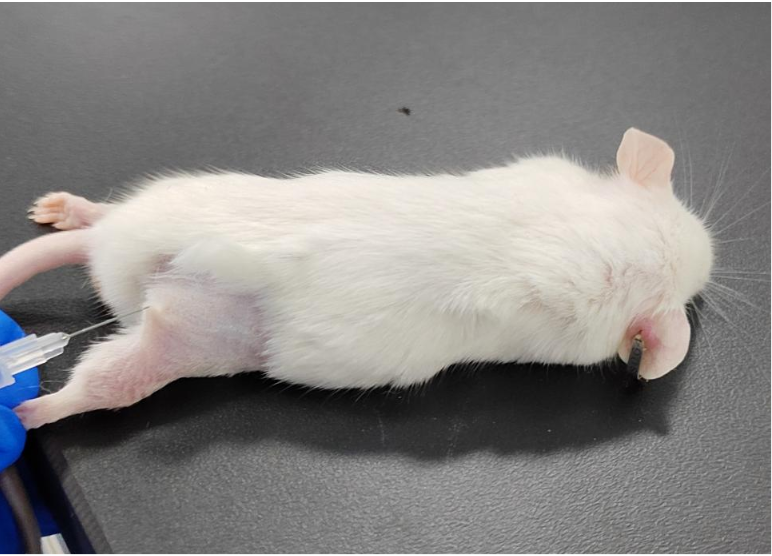
肌肉注射:一般注射部位为大腿外侧肌肉。注射前,将小鼠麻醉后剃除注射部位的毛发。常规消毒注射部位,针头与注射部位垂直进针,进针深度约 0.5cm,回抽针筒,若有血液回流,则需重新进针。确认插入肌肉后,缓慢注射药物,以防损伤组织和药物溢出。
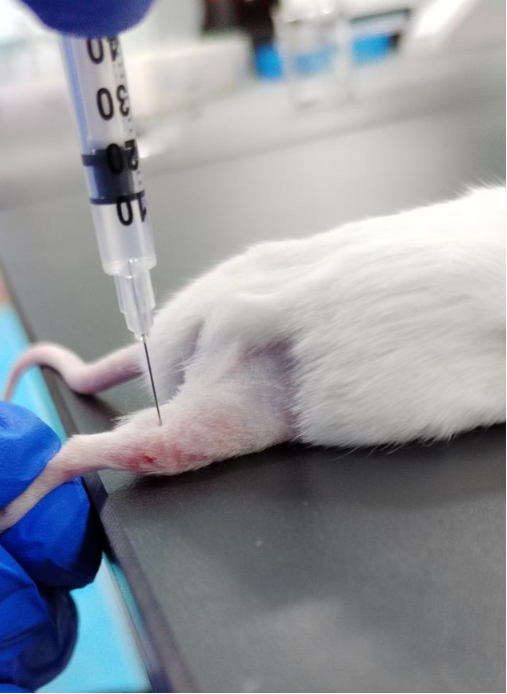
尾静脉注射:大小鼠尾部左右两侧各有一条静脉,位置较浅,常作为注射部位。首先,用保定器把小鼠保定,露出其尾部。然后,用浸泡在 50℃ 左右温水的毛巾热敷尾部,使血管扩张,再用酒精擦拭。左手托起尾部,右手持针,使针头与静脉平行,从距离尾尖约 2-3cm 的位置开始进针。若注射时没有阻力,且观察到血管整条由红变白,则注射成果。
腹腔注射:腹腔注射的药物吸收速率比尾静脉注射慢,但是该注射方式的给药量要大于尾静脉注射。注射时,左手固定小鼠。翻转小鼠,使小鼠头部向下,腹部向上,呈 45° 角。由于重力作用,可使腹腔中肠道等重要器官倒向胸部,避免注射时损失脏器。于左下腹进行消毒处理,右手持注射器,以 45° 角进针,进针深度约 1cm。进针感觉明显落空感,回抽较吃力且仅有空气被吸入,则说明进针成果。最后,缓慢注射药物。
注意事项
在给动物用药时,首先根据需要选择注射器的规格和材料,注射器按容量有 5、10、20、50、100 毫升等规格, 按材料有金属、玻璃、塑料等。其次要谨慎检查注射药物的适合用途,有无变质、混浊、沉淀,如同时使用 2 种以上药液,需注意药物间的配伍禁忌。




