Real-time PCR(基本方法一)
材料与仪器
RNA 提取试剂盒、DNase I、琼脂糖、DEPC 水、甲醛、凝胶板
步骤
实时荧光定量 PCR(Real-Time PCR)实验流程
一、RNA 的提取
不同组织样本的 RNA 提取适用不同的提取方法,在总 RNA 的提取过程中,注意避免 mRNA 的断裂;取 2 μg 进行 RNA 的甲醛变性胶电泳检测,如果存在 DNA 污染时,要用 DNase I 进行消化(因为在处理过程中 RNA 极易降解,建议体系中加入适量 RNA 酶抑制剂)。
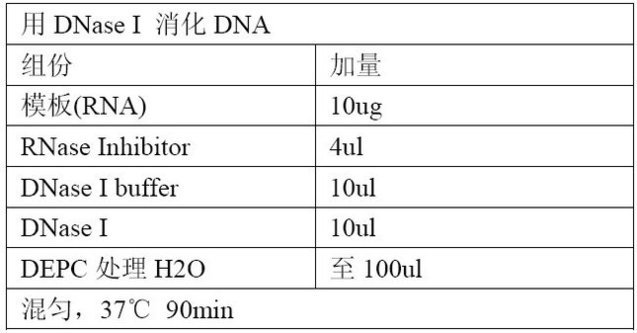
二、DNase I 消化样品 RNA 中的 DNA。

三、RNA 琼脂糖凝胶电泳
1. 1% 的琼脂糖凝胶电泳凝胶的配制:
1)称取琼脂糖 0.45 g 放入三角瓶中,向其中加入 4.5 ml 的 10 × MOPS 缓冲液和 39.5 ml 的 DEPC 水,放微波炉里溶化。
2)待冷却到 60 摄氏度左右时,加入 1 ml 甲醛,摇匀(避免产生气泡)。倒入凝胶板上凝固 30 min。
2. 取各个 RNA 样品 4 μl,加入 6 × RNA 电泳上样缓冲液 2 μl 混匀,加入变性胶加样孔中。
3. 120 V 电压下电泳 25 min。用凝胶紫外分析仪观察,照相保存。
4. RNA 电泳结果如下图所示。可见 28S 和18S 两条明亮条带,无 DNA 条带污染。

另外还有一种 RNA 检测方法为浓度检测,取 4 μl RNA,加蒸馏水至 1 000 μl,混匀,测 OD260、OD280。
四、RNA 反转录为 cDNA
反转录程序(以 MBI 的 M-MLV 为例)

反转录引物的选择与 Real-Time PCR 引物设计的要求
1)随机六聚体引物:
当特定 mRNA 由于含有使反转录酶终止的序列而难以拷贝其全长序列时,可采用随机六聚体引物这一不特异的引物来拷贝全长 mRNA。用此种方法时,体系中所有 RNA 分子全部充当了 cDNA 第一链模板,PCR 引物在扩增过程中赋予所需要的特异性。通常用此引物合成的 cDNA 中 96% 来源于 rRNA。
2)Oligo(dT):
是一种仅对 mRNA 特异的方法。因绝大多数真核细胞 mRNA 具有 3' 端 Poly(A+)尾,此引物与其配对,仅 mRNA 可被转录。由于 Poly(A+)RNA 只占总 RNA 的 1-4%,故此种引物合成的 cDNA 比随机六聚体作为引物和得到的 cDNA 在数量和复杂性方面均要小。特别适合检测多个基因的表达,这样可以节约反转录的试剂,cDNA 可以多次使用,可用于检测稀有基因是否表达、从极少量细胞中定量检测特定 mRNA 的表达水平。
3)特异性引物:
最特异的反转录方法是用含目标 RNA 的互补序列的寡核苷酸作为引物,若 PCR 反应用二种特异性引物,第一条链的合成可由与 mRNA 3' 端最靠近的配对引物起始。用此类引物仅产生所需要的 cDNA,导致更为特异的 PCR 扩增。
做 Real Time PCR时,用于 SYBR Green I/Eva Green 法时的一对引物与一般 PCR 的引物,在引物设计上所要求的参数是不同的。引物设计的要求:
① Tm = 55 - 65 ℃
② GC = 30 - 80%
③ PCR扩增产物长度:引物的产物大小不要太大,一般在 80~300 bp 之间都可。
④ 引物的退火温度要高,一般要在 60 ℃ 以上。
要特别注意避免引物二聚体和非特异性扩增的存在。而且引物设计时应该考虑到引物要有不受基因组 DNA 污染影响的能力,即引物应该跨外显子,最好是引物能跨外显子的接头区,这样可以更有效的不受基因组 DNA 污染的影响。
至于设计软件,PRIMER3,PRIMER5,PRIMER EXPRESS 都应该可以的。做染料法最关键的就是寻找到合适的引物和做污染的预防工作。对于引物,你要有从一大堆引物中挑出一两个能用的引物的思想准备---寻找合适的引物非常不易。
五、cDNA 与引物质量检测
取 0.2 ml 薄壁 PCR 管,编号。向各管中加入含染料 2 × PCR TaqMix 10 μl;加入正反向引物各 0.5 μl(引物浓度 10 μM),向管中加入混合的 cDNA 各 1 μl。各管补加水至 20 μl。
组份、加量
2 × PCRTaqMix 10 μl
10 μMPrimer FW 0.5 μl
10 μMPrimer RV 0.5 μl
Template DNA 1 μl
混匀,置于 TP600PCR 仪中。95 ℃ 5 min;95 ℃15 s,60 ℃ 35 s,40 cycles;72 ℃ 5 min;4 ℃ pause。
取扩增产物各 8 μl,DL2 000 分子量标准 5 μl/ 泳道。1% 琼脂糖凝胶 120 V 电压下电泳 25 min。用凝胶紫外分析仪观察。
选择特异性好,扩增效率高的引物作为实时荧光使用引物。
六、利用相对定量的方法分析目的基因表达量的情况
由于 RNA 纯化后得率不同、RNA 反转录为 cDNA 的效率不同等客观因素,用于定量分析的初始样品浓度不同,因此,在进行基因表达调控研究中都会用一些看家基因来标准化,以校正因样品初始浓度不同而造成的差异。常用的看家基因有 beta-actin,GAPDH,18SrRNA 等。因此,在做基因表达调控分析时至少要做两个基因,目的基因和一个看家基因。
七、定量 PCR 检测
取 0.2 ml 薄壁 PCR 管,分别编号。向各管中加入 2 × qPCR TaqMix 12.5 μl,10 μM 各基因正反向引物混合物 0.5 μl,对应的 cDNA 各 1 μl。一管中不加模板用作阴性对照。各管补加水至 25 μl。

混匀,置于 SLAN 荧光定量 PCR 仪中。95 ℃ 5 min 预变性后,95 ℃ 15 s→65 ℃ 35 s(荧光检测 ,40 cycles。荧光定量 PCR 一般把退火和扩增设成一个温度,只在扩增出现问题时才会考虑设梯度。
(侯哥论文中的:95 °C 10 分钟→95 °C 15 秒→60 °C 1 分钟;40 个循环。)
以双 △Ct 值法计算靶基因相对表达水平:
GRP78 相对表达水平 = 2 - △(△CT)
注:△CT = Ct(GRP78)- Ct(GAPDH);△(△CT)= △CT(LLLI)- △CT(contro1)。
八、扩增曲线和溶解曲线
溶解曲线全部为单峰表明为特异性扩增。
一般而言,荧光扩增曲线可以分成三个阶段:荧光背景信号阶段,荧光信号指数扩增阶段和平台期,其形状是一条平滑的 S 型曲线。
如果在荧光背景信号阶段出现很多拐点,可能的原因是体系未混匀或者存在固态杂质;
如果向下探头后又很快抬头然后又向下探头,可能原因是体系中模板量太高,建议模板稀释后再用。
如果引物二聚体存在则阴性对照会出现抬头现象,这在 Real-Time PCR 中很难避免;
若是阴性对照的溶解曲线出现和样品中同样的峰,说明体系配置中存在污染,则实验结果不可用。
在溶解曲线中出现双峰有三种可能:
① 引物峰,引物峰通常是两峰中的前面一个,消除的办法是降低体系中的引物量或重新设计引物;
② 在做基因表达差异时容易出现 DNA 被扩增峰(只在引物跨内含子时存在),出现原因是提取 RNA 时存在 DNA 污染,可以通过电泳验证,这时要重新消化 RNA 样品中的 DNA;
③ 扩增非特异,这时要重新摸扩增条件或重新设计并验证引物。
九、表达差异的计算方法
绝对定量通过标准曲线计算起始模板的拷贝数;相对定量方法则是比较经过处理的样品和未经处理的样品目标转录本或是目标转录本在不同时相的表达差异之间的表达差异。
2-△△CT 方法是实时定量 PCR 实验中分析基因表达相对变化的一种简便方法。
在有些情况下,并不需要对转录本进行绝对定量,只需要给出相对基因表达差异即可。显然,我们说X基因在经过某种处理后表达量增加2.5倍比说该基因的表达从 1 000 拷贝/细胞增加到 2 500 拷贝/细胞更加直观。
2-△△CT 方法的推导(详见实时定量 PCR 和 2-△△CT 法分析基因相对表达量)
补充:在 DNase I 消化样品 RNA 中的 DNA 后,需要对样品重新进行氯仿抽提,具体实验流程如下:
消化后总体积 100 μl,体积太少,不利于抽提,我们往往补加 200 μl DEPC 水。
1. 向离心管中加入等体积氯仿(约 300 μl),剧烈颠倒,充分混匀至中层出现白色片状沉淀。4 ℃ 14 000 rpm 离心 8 min,取上清(约 250 μl)。
2. 加入 1/10 体积的 NaAC(3 M)(约 25 μl)和预冷的等体积异丙醇(约 280 μl),-20 ℃ 放置 20 min。
3. 4 ℃ 14 000 rpm 离心 15 min,去上清,注意不要触到沉淀。
4. 加入 1 ml 的 75% 乙醇,4 ℃ 14 000 rpm 离心 3 min,去上清。
5. 瞬时离心,用 200 μl(或 10 μl)的枪头小心吸去离心管底的残存液态(勿吸到管底的沉淀)。
6. 把离心管放置于超净台晾至约 5~10 分钟(勿完全干燥,否则很难溶)。加入 30~50 μl 的无 RNase 的水,静止 1 min 后,振荡 30 sec,瞬时离心。
7. 将提取的 RNA 立即进行下游实验,或放 -20 ℃ 保存。
注意事项
1、加入试剂之前,把它混匀一下,以免放置时间长了浓度不均。
2、移液枪用完之后要归到最大计量的位置,防止久而久之弹簧失去弹性。
3、防止 RNA 酶污染的措施。
① 所有的玻璃器皿均应在使用前于 180 ℃ 的高温下干烤 6 h 或更长时间。
② 塑料器皿可用 0.1% DEPC 水浸泡或用氯仿冲洗(注意:有机玻璃器具因可被氯仿腐蚀,故不能使用)。
③ 有机玻璃的电泳槽等,可先用去污剂洗涤,双蒸水冲洗,乙醇干燥,再浸泡在 3% H2O2 室温 10 min,然后用 0.1% DEPC 水冲洗,晾干。
④ 配制的溶液应尽可能的用 0.1% DEPC,在 37 ℃ 处理 12 h 以上。然后用高压灭菌除去残留的 DEPC。不能高压灭菌的试剂,应当用 DEPC 处理过的无菌双蒸水配制,然后经 0.22 μm 滤膜过滤除菌。
⑤ 操作人员戴一次性口罩、帽子、手套,实验过程中手套要勤换。
⑥ 设置 RNA 操作专用实验室,所有器械等应为专用。
相关文章
- RT-PCR、Western blot和ELISA三者的区别
- PCR反应五要素
- 原位聚合酶链式反应(in situ PCR)和原位反转录聚合酶链式反应(in situ RT-PCR)操作规程
- A sensitive quantification of HHV-6B by real-time PCR
- PCR标准反应体系
- Validation of RNAi by Real Time PCR
- Site-Directed Mutagenesis and Gene Fusion by Megaprimer PCR
- 逆转录-聚合酶链反应 (Reverse Transcription-Polymerase Chain Reaction,RT-PCR
- 锚定PCR
- Real-Time PCR Fluorescent Chemistries




