用寡聚(dT)作引物合成放射性标记的扣除cDNA探针
原理本方案描述通过与 mRNA 驱动方杂交,继之以羟基磷灰石层析纯化单链放射性标记的 cDNA,制备扣除 cDNA 探针。材料与仪器反转录酶 反转录酶缓冲液 驱
原理
本方案描述通过与 mRNA 驱动方杂交,继之以羟基磷灰石层析纯化单链放射性标记的 cDNA,制备扣除 cDNA 探针。
材料与仪器
反转录酶 反转录酶缓冲液 驱动方 mRNA 模板 mRNA
乙酸铵 DTT EDTA 乙醇 HCl 异丁醇 NaOH 酚 氯仿 胎盘 RNA 酶抑制剂 SDS SDS EDTA 溶液 磷酸盐缓冲液 SPS 缓冲液 dNTP 溶液
沸水浴 冰水浴 矿物油 Sephadex G-50 柱 微量离心管 水浴或加热板
乙酸铵 DTT EDTA 乙醇 HCl 异丁醇 NaOH 酚 氯仿 胎盘 RNA 酶抑制剂 SDS SDS EDTA 溶液 磷酸盐缓冲液 SPS 缓冲液 dNTP 溶液
沸水浴 冰水浴 矿物油 Sephadex G-50 柱 微量离心管 水浴或加热板
步骤
一、材料
1. 缓冲液与溶液
乙酸铵(10 mol/L)
DTT (1 mol/L)
EDTA ( 0.5 mol/L,pH 8.0)
乙醇
HCl ( 2.5 mol/L)
异丁醇
NaOH ( 3 mol/L)
酚:氯仿(1:1,V/V)
胎盘 RNA 酶抑制剂(20 单位/μl)
SDS ( 10% m/V)
SDS/EDTA 溶液(30 mmol/L EDTA (pH 8.0),1.2% SDS)
磷酸盐缓冲液(2 mol/L,pH 6.8)
SPS 缓冲液(0.12 mol/L(pH 6.8),0.1% (m/V) SDS)
Tris-Cl ( 1 mol/L,pH 7.4)
2. 酶与缓冲液
反转录酶
10X 反转录酶缓冲液
3. 核酸与寡核苷酸
dCTP ( 125 μmol/L)
含 dATP、dGTP 和 dTTP 各 20 mmol/L 的 dNTP 溶液
驱动方 mRNA
oligo (dT)12-18
模板 mRNA
4. 放射性化合物
[α-32P] dCTP ( 10 mCi/ml,比活性为 >3000 Ci/mmol)
5. 专用设备
在 60℃ 下用羟基磷灰石层析分离单链和双链核酸的装置
沸水浴
冰水浴
矿物油,尖部拉长的可接到自动进样器上的吸头,或硅化的一次性 20 μl 玻璃毛细管、锉刀或钻石刀
Sephadex G-50 柱(5 ml),用 TE ( pH 8.0)平衡
Sephadex G-50 离心柱,用含 0.1% SDS 的 TE ( pH 8.0)平衡
硅化的微量离心管(1.5 ml)
预热至 45℃、68℃ 和 70℃ 的水浴或加热板
二、方法
1. 将 5~10 μg poIy(A)+ RNA 转移到一个灭菌的微量离心管,用无 RNA 酶的水将 poIy(A)+ RNA 的体积调至 40 μl。盖紧管盖,70℃ 加热 5 min,然后迅速将微量管移至冰水浴。
2. 向冷却的微量管中加入:
0.1 mol/L DTT 2.5 μl
胎盘 RNA 酶抑制剂 200 单位
oligo (dT)12-18 10 μl
10X 反转录缓冲液 25 μl
20 mmol/L dGTP、dATP、dTTP 溶液 10 μl
125 μmol/L dCTP 10 μl
10 mCi/ml [α-32P] dCTP
( 比活性为 > 3000 Ci/mmol) 100 μl
无 RNA 酶的水 加至 240 μl
反转录酶(2000 单位) 10 μl
轻敲管外壁以混合各组分,微量离心机内稍加离心以收集管底的反应混合物,45℃ 下温育反应 1 h。
3. 加入以下试剂以终止反应:
0.5 mol/L EDTA (pH 8.0) 10 μl
10% (m/V) SDS 10 μl
'混匀管中的试剂。
4. 向反应管中加入 30 μl 3 mol/L NaOH。于 68℃ 温育反应混合物 30 min 以水解 RNA。
5. 冷却反应混合物至室温,加入 100 μl 1 mol/L Tris-Cl (pH 7.4) 中和溶液,混匀,然后加 30 μl 2.5 mol/L HCl。在 pH 纸上点一小滴(< 1 μl)溶液检测其 pH。
6. 用酚:氯仿抽提纯化 cDNA。
7. 用 TCA 沉淀法或 DE-81 滤膜结合法检测放射性标记的 dNTP 掺入的比例。按以下公式计算 cDNA 的产率:
在含 1.5 nmol 限量 dNTP 的反应中:
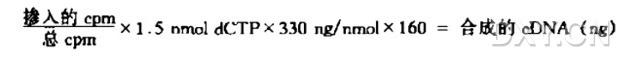
8. 通过 5 ml Sephadex G-50 柱层析分离放射性标记的探针与未掺人的 dNTP。
9. 在放射性标记的 cDNA 中,加入 10 倍重量的驱动方 RNA,用来扣除 cDNA 探针,并加入 0.2 体积的 10 mol/L 乙酸铵和 2.5 体积的冰冷乙醇。于 0℃ 放置 10~15 min,然后在微量离心机中以最大速度在 4℃ 下离心 5 min 回收核酸。
10. 吸去所有的乙醇,敞开管盖,置于试验台上使剩余的乙醇蒸发。将核酸溶于 6 μl 无 RNA 酶的水中。
11. 在溶解的核酸中加入:
2 mol/L 磷酸钠(pH 6.8) 2 μl
SDS/EDTA 溶液 2 μl
12. 用一滴轻矿物油覆盖于溶液上或将混合物吸入硅化的一次性 20 μl 玻璃毛细管,并在本生灯火焰上封住毛细管两端。
13. 将微量离心管或封口的毛细管放入沸水浴中 5 min,再移至 68℃ 水浴杂交,直至 Cr0t = 1000 mol·s/L。

14. 从水浴中取出微量离心管或毛细管。用一个尖部拉长的吸头连到微量进样器上,从微量离心管中吸出杂交液,或用锉或钻石笔打开毛细管的一端,将杂交反应液转移到含有 1 ml SPS 缓冲液的管中。
15. 在 60℃ 下通过羟基磷灰石层析分离单链和双链核酸。
16. 合并含单链 cDNA 的各组分,用异丁醇反复抽提浓缩:加等量异丁醇,漩涡振荡混匀两相,室温下以最大速度在微量离心机中离心 2 min,弃上(有机)相。反复用异丁醇抽提,直到水相体积 <100 μl。
17. 通过以含 0.1% SDS 的 TE ( pH 8.0) 平衡的 Sephadex G-50 离心柱层析,去除 cDNA 中的盐。
18. 检测样品中的放射性量,计算扣除探针中 DNA 的重量。
19. 重复步骤 9~18。
10%~30% 的 cDNA 将在第二轮杂交中与驱动方 RNA 形成杂交体。
1. 缓冲液与溶液
乙酸铵(10 mol/L)
DTT (1 mol/L)
EDTA ( 0.5 mol/L,pH 8.0)
乙醇
HCl ( 2.5 mol/L)
异丁醇
NaOH ( 3 mol/L)
酚:氯仿(1:1,V/V)
胎盘 RNA 酶抑制剂(20 单位/μl)
SDS ( 10% m/V)
SDS/EDTA 溶液(30 mmol/L EDTA (pH 8.0),1.2% SDS)
磷酸盐缓冲液(2 mol/L,pH 6.8)
SPS 缓冲液(0.12 mol/L(pH 6.8),0.1% (m/V) SDS)
Tris-Cl ( 1 mol/L,pH 7.4)
2. 酶与缓冲液
反转录酶
10X 反转录酶缓冲液
3. 核酸与寡核苷酸
dCTP ( 125 μmol/L)
含 dATP、dGTP 和 dTTP 各 20 mmol/L 的 dNTP 溶液
驱动方 mRNA
oligo (dT)12-18
模板 mRNA
4. 放射性化合物
[α-32P] dCTP ( 10 mCi/ml,比活性为 >3000 Ci/mmol)
5. 专用设备
在 60℃ 下用羟基磷灰石层析分离单链和双链核酸的装置
沸水浴
冰水浴
矿物油,尖部拉长的可接到自动进样器上的吸头,或硅化的一次性 20 μl 玻璃毛细管、锉刀或钻石刀
Sephadex G-50 柱(5 ml),用 TE ( pH 8.0)平衡
Sephadex G-50 离心柱,用含 0.1% SDS 的 TE ( pH 8.0)平衡
硅化的微量离心管(1.5 ml)
预热至 45℃、68℃ 和 70℃ 的水浴或加热板
二、方法
1. 将 5~10 μg poIy(A)+ RNA 转移到一个灭菌的微量离心管,用无 RNA 酶的水将 poIy(A)+ RNA 的体积调至 40 μl。盖紧管盖,70℃ 加热 5 min,然后迅速将微量管移至冰水浴。
2. 向冷却的微量管中加入:
0.1 mol/L DTT 2.5 μl
胎盘 RNA 酶抑制剂 200 单位
oligo (dT)12-18 10 μl
10X 反转录缓冲液 25 μl
20 mmol/L dGTP、dATP、dTTP 溶液 10 μl
125 μmol/L dCTP 10 μl
10 mCi/ml [α-32P] dCTP
( 比活性为 > 3000 Ci/mmol) 100 μl
无 RNA 酶的水 加至 240 μl
反转录酶(2000 单位) 10 μl
轻敲管外壁以混合各组分,微量离心机内稍加离心以收集管底的反应混合物,45℃ 下温育反应 1 h。
3. 加入以下试剂以终止反应:
0.5 mol/L EDTA (pH 8.0) 10 μl
10% (m/V) SDS 10 μl
'混匀管中的试剂。
4. 向反应管中加入 30 μl 3 mol/L NaOH。于 68℃ 温育反应混合物 30 min 以水解 RNA。
5. 冷却反应混合物至室温,加入 100 μl 1 mol/L Tris-Cl (pH 7.4) 中和溶液,混匀,然后加 30 μl 2.5 mol/L HCl。在 pH 纸上点一小滴(< 1 μl)溶液检测其 pH。
6. 用酚:氯仿抽提纯化 cDNA。
7. 用 TCA 沉淀法或 DE-81 滤膜结合法检测放射性标记的 dNTP 掺入的比例。按以下公式计算 cDNA 的产率:
在含 1.5 nmol 限量 dNTP 的反应中:
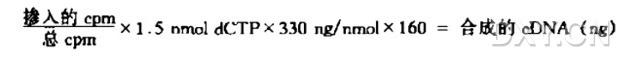
8. 通过 5 ml Sephadex G-50 柱层析分离放射性标记的探针与未掺人的 dNTP。
9. 在放射性标记的 cDNA 中,加入 10 倍重量的驱动方 RNA,用来扣除 cDNA 探针,并加入 0.2 体积的 10 mol/L 乙酸铵和 2.5 体积的冰冷乙醇。于 0℃ 放置 10~15 min,然后在微量离心机中以最大速度在 4℃ 下离心 5 min 回收核酸。
10. 吸去所有的乙醇,敞开管盖,置于试验台上使剩余的乙醇蒸发。将核酸溶于 6 μl 无 RNA 酶的水中。
11. 在溶解的核酸中加入:
2 mol/L 磷酸钠(pH 6.8) 2 μl
SDS/EDTA 溶液 2 μl
12. 用一滴轻矿物油覆盖于溶液上或将混合物吸入硅化的一次性 20 μl 玻璃毛细管,并在本生灯火焰上封住毛细管两端。
13. 将微量离心管或封口的毛细管放入沸水浴中 5 min,再移至 68℃ 水浴杂交,直至 Cr0t = 1000 mol·s/L。

14. 从水浴中取出微量离心管或毛细管。用一个尖部拉长的吸头连到微量进样器上,从微量离心管中吸出杂交液,或用锉或钻石笔打开毛细管的一端,将杂交反应液转移到含有 1 ml SPS 缓冲液的管中。
15. 在 60℃ 下通过羟基磷灰石层析分离单链和双链核酸。
16. 合并含单链 cDNA 的各组分,用异丁醇反复抽提浓缩:加等量异丁醇,漩涡振荡混匀两相,室温下以最大速度在微量离心机中离心 2 min,弃上(有机)相。反复用异丁醇抽提,直到水相体积 <100 μl。
17. 通过以含 0.1% SDS 的 TE ( pH 8.0) 平衡的 Sephadex G-50 离心柱层析,去除 cDNA 中的盐。
18. 检测样品中的放射性量,计算扣除探针中 DNA 的重量。
19. 重复步骤 9~18。
10%~30% 的 cDNA 将在第二轮杂交中与驱动方 RNA 形成杂交体。





