低熔点琼脂糖凝胶中DNA的回收(用琼脂糖酶消化)
原理可用琼脂糖酶消化的方法从低熔点琼脂糖凝胶中回收 DNA ( Bumeister and lehrach 1989)。在这种方法中,琼脂糖酶使琼脂糖多聚体水解
原理
可用琼脂糖酶消化的方法从低熔点琼脂糖凝胶中回收 DNA ( Bumeister and lehrach 1989)。在这种方法中,琼脂糖酶使琼脂糖多聚体水解为双糖。这样获得的 DNA 再经酚抽提、乙醇沉淀进行纯化。由于该法较为温和,因此特别适用从脉冲场琼脂糖凝胶中 回收高分子质量的 DNA,从恒强电场琼脂糖凝胶中回收小分子 DNA 也同样有效。
材料与仪器
琼脂糖酶 DNA 样品
乙醇 溴化乙锭或 SYBR Gold 染色液 凝胶平衡缓冲液 Bis Tris-Cl EDTA NaCl 平衡酚 TE
煮沸过的透析袋 微透析装置 紫外灯 水浴
乙醇 溴化乙锭或 SYBR Gold 染色液 凝胶平衡缓冲液 Bis Tris-Cl EDTA NaCl 平衡酚 TE
煮沸过的透析袋 微透析装置 紫外灯 水浴
步骤
一、材料
1. 缓冲液和瑢液
乙醇
溴化乙锭或 SYBR Gold 染色液
凝胶平衡缓冲液(10 mmol/L Bis Tris-Cl ( pH 6.5),5 mmol/L EDTA ( pH 8.0),0.1 mol/L NaCl)
NaCl ( 5 mol/L)
平衡酚(pH 8.0)
TE ( pH 8.0)
2. 酶及缓冲液
琼脂糖酶
3. 核酸和寡核苷酸
DNA 样品
4. 专用设备
煮沸过的透析袋
微透析装置(Life Technologies)
手提式长波(302 nm) 紫外灯
预置温度 40℃ 和 65℃ 的水浴
二、方法
1. 制备低熔点琼脂糖凝胶,上样并电泳。
2. 从琼脂糖凝胶上切下含目的 DNA 的条带,转移至微量离心管内,加入 20 倍体积的凝胶平衡缓冲液,室温静置 30 min。
3. 拍摄切除目的 DNA 条带的凝胶,以记录被切下的 DNA 条带。
4. 将凝胶切片转移至另一约含等体积凝胶平衡缓冲液的新微量离心管中。
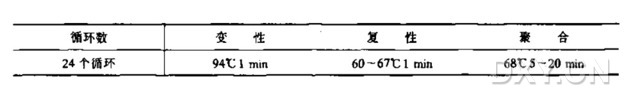
5. 65℃ 温育 10 min, 使凝胶切片熔化。冷却至 40℃,加入无 DNA 酶的琼脂糖酶,每 200 μl 凝胶加入 1~2 单位。40℃ 温育 1 h。
在此期间,琼脂糖被切为寡糖或双糖。如需要,此时的 DNA 溶液可直接用来进行连接、酶切以及转化等实验。
6. DNA 的纯化和浓缩
(1) 纯化小片段 DNA ( <20kb)
① 用平衡酚抽取 DNA 溶液两次。
② 第二次酚抽取完毕,将水相转移至另一新管中,加入 2 倍体积的 TE (pH 8.0)。
③ 加入 0.05 倍体积 5 mol/L 的 NaCl,随后加入 2 倍体积的乙醇(这里的体积指步骤 6 ② 中的 DNA 终体积)。置 0℃ 预冷 15 min, 微量离心机 4℃ 以最大转速离心 15 min 收集沉淀。
④ 小心地吸出乙醇,加入 0.5 ml 处于室温的 70% 乙醇。混合均匀,按步骤 ③ 所述离心。
⑤ 吸去上清,打开离心管。置于操作台上数分钟,挥发去除残留乙醇。将 DNA 溶于适当体积的 TE ( pH 8.0)中。
(2) 纯化大片段 DNA (>20kb)
① 将琼脂糖酶消化过的样品移至一透析袋中,扎好或封好后将透析袋放在含 100 ml TE ( pH 8.0 ) 的烧杯或三角瓶中。
② 4℃ 透析样品数小时。
1. 缓冲液和瑢液
乙醇
溴化乙锭或 SYBR Gold 染色液
凝胶平衡缓冲液(10 mmol/L Bis Tris-Cl ( pH 6.5),5 mmol/L EDTA ( pH 8.0),0.1 mol/L NaCl)
NaCl ( 5 mol/L)
平衡酚(pH 8.0)
TE ( pH 8.0)
2. 酶及缓冲液
琼脂糖酶
3. 核酸和寡核苷酸
DNA 样品
4. 专用设备
煮沸过的透析袋
微透析装置(Life Technologies)
手提式长波(302 nm) 紫外灯
预置温度 40℃ 和 65℃ 的水浴
二、方法
1. 制备低熔点琼脂糖凝胶,上样并电泳。
2. 从琼脂糖凝胶上切下含目的 DNA 的条带,转移至微量离心管内,加入 20 倍体积的凝胶平衡缓冲液,室温静置 30 min。
3. 拍摄切除目的 DNA 条带的凝胶,以记录被切下的 DNA 条带。
4. 将凝胶切片转移至另一约含等体积凝胶平衡缓冲液的新微量离心管中。
5. 65℃ 温育 10 min, 使凝胶切片熔化。冷却至 40℃,加入无 DNA 酶的琼脂糖酶,每 200 μl 凝胶加入 1~2 单位。40℃ 温育 1 h。
在此期间,琼脂糖被切为寡糖或双糖。如需要,此时的 DNA 溶液可直接用来进行连接、酶切以及转化等实验。
6. DNA 的纯化和浓缩
(1) 纯化小片段 DNA ( <20kb)
① 用平衡酚抽取 DNA 溶液两次。
② 第二次酚抽取完毕,将水相转移至另一新管中,加入 2 倍体积的 TE (pH 8.0)。
③ 加入 0.05 倍体积 5 mol/L 的 NaCl,随后加入 2 倍体积的乙醇(这里的体积指步骤 6 ② 中的 DNA 终体积)。置 0℃ 预冷 15 min, 微量离心机 4℃ 以最大转速离心 15 min 收集沉淀。
④ 小心地吸出乙醇,加入 0.5 ml 处于室温的 70% 乙醇。混合均匀,按步骤 ③ 所述离心。
⑤ 吸去上清,打开离心管。置于操作台上数分钟,挥发去除残留乙醇。将 DNA 溶于适当体积的 TE ( pH 8.0)中。
(2) 纯化大片段 DNA (>20kb)
① 将琼脂糖酶消化过的样品移至一透析袋中,扎好或封好后将透析袋放在含 100 ml TE ( pH 8.0 ) 的烧杯或三角瓶中。
② 4℃ 透析样品数小时。