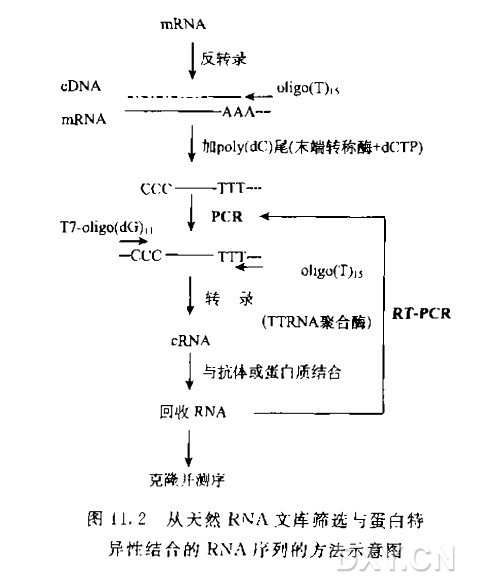
Northwestern筛选蛋白表达文库实验
原理Northwestern 筛选蛋白表达文库的方法是通过构建 IPTG 可诱导的融合蛋白表达文库(融合蛋白的 N 端由载体序列编码,C 端由克隆到载体的 cD
原理
Northwestern 筛选蛋白表达文库的方法是通过构建 IPTG 可诱导的融合蛋白表达文库(融合蛋白的 N 端由载体序列编码,C 端由克隆到载体的 cDNA 文库编码),进而诱导融合蛋白表达,并将蛋白质固定于硝酸纤维素滤膜上,以标记的 RNA 探针进行筛选,最终获取能与靶 RNA 分子特异性结合蛋白质的 cDNA。
材料与仪器
表达库 宿主菌 抗生素
SM 缓冲液 IPTG 封闭缓冲液 漂洗缓冲液 结合缓冲液 洗脱缓冲液 Ficoll PVP BSA Torula yeast core RNA
NZY 培养基 LB 培养基 NZY 顶层琼脂 NZY 平板 硝酸纤维素膜 RNA 探针
SM 缓冲液 IPTG 封闭缓冲液 漂洗缓冲液 结合缓冲液 洗脱缓冲液 Ficoll PVP BSA Torula yeast core RNA
NZY 培养基 LB 培养基 NZY 顶层琼脂 NZY 平板 硝酸纤维素膜 RNA 探针
步骤
―、材料与设备
1. 表达库:多采用 λ 噬菌体载体构建表达库,可根据需要选取载体。可购买预先制备好的表达库(Stratagenc 公司,Clontech 公司等均有售),也可以自己制备载体库。如 λgt11、λZAP 或 λORF8 等载体的多克隆位点前有 lacZ 基因,使融合蛋白能被 TPTG 诱导表达。改进型载体如 λTriplEx 可以使三个读码框都得到翻译,保证了蛋白质的表达。此外,还可以将组蛋白与 β-半乳糖苷酶融合,以便釆用蓝-白斑筛选重组体;在 λTriplEx 载体中加入 E.coli ompA 基因的 5'-UTR 可以提高重组体的稳定性。
2. 宿主菌:宿主菌一定要与库载体相对应。如 E.coli XL I-blue 可用作 λTriplEx 载体和 λZAP 载体的宿主菌。XL I-blue 菌的附加体 F' 中含有 △M15 lacZ 和 lac Iq 基因:△M15 lacZ 基因的表达可以通过 α 互补对重组克隆进行蓝-白斑筛选;lacIq 基因编码 lac 抑制子,在诱导剂 TPTG 不存在时抑制 lacZ 启动子的转录。
3. NZY 培养基:5 g NaCl,2 g MgSO4·7H2O,5 g 酵母提取物,10 g NZ胺(酪蛋白的酶促水解产物),定容至 1 L,高压灭菌后保存。
4. LB 培养基:10 g 蛋白胨,5 g 酵母提取物,10 g NaCl,定容至 1 L,调 pH 7.4,高压灭菌后保存。
5. NZY 顶层琼脂:NZY 培养基中加 0.7% 琼脂糖,高压灭菌。
6. NZY 平板:在 1 L NZY 培养基中加 15 g 琼脂粉,高压灭菌后铺板(约 70 ml/150 mm 培养皿,约 30 ml/100 mm 培养皿)。
7. 抗生素:氨芐青霉素:50 μg/ml;四环素:12.5 μg/ml。
8. SM 缓冲液:5.8 g NaCl,2 g MgSO4·7H2O,50 ml 1 mol/L Tris-HCl(pH 7.5),5 ml 2% 明胶,定容于 1 L,高压灭菌。
9. 0.5 mol/L IPTG,X-Gal(2.5 g X-Gal 溶解于 10 ml 二甲基甲酰胺中),20% 麦芽糖,均过滤除菌。
10. 硝酸纤维素膜(建议使用 supported nitnKdliilose,BA-S85,Schleicher&-Schuell 公司)。
11. 32P 标记的 RNA 探针:常规制备,以含 7 mol/L 尿素的丙烯酰胺胶垂直电泳对探针进行纯化,用 HSCB 缓冲液 [ 25 mmol/L Tris-HCl(pH 7.5 ),400 mmol/L NaCl,0.1% SDS ] 洗脱过夜。
12. 封闭缓冲液:5 mg/ml Torula yeast core RNA(Sigma 公司),10 mmol/L Tris- HCl(pH 7.8),150 mmol/L NaCl。
13. 漂洗缓冲液:10 mmol/L Tris-HCl(pH 7.8 )。
14. 结合缓冲液:10 mmol/L Tris-HCl(pH 7.8),1 mmol/L EDTA,0.02% Ficoll,0.02% 聚乙稀吡咯烷酮(polyvinylpyrrolidone,PVP),0.02% 牛血清白蛋白及预试验确定浓度的 NaCl(通常为 50 mmol/L 左右)。
15. 洗脱缓冲液:10 mmol/L Tris-HCl(pH 7.8),1 mmol/L EDTA,0.02% Ficoll,0.02% PVP,0.02% 牛血清白蛋白及预试验确定浓度的 NaCl(通常为 100 mmol/L 左右)。
16. 2% Ficoll(10X 储存液):2 g Ficoll ( type 400 ) 溶解于 100 ml 蒸馏水中,110℃ 灭菌 15 min,4℃ 可保存 1 个月。
17. 2% PVP(10X 储存液):2 g PVP(分子质量为 40000 Da)溶解于 100 ml 蒸馏水中,110°C 灭菌 15 min,4°C 可保存 1 个月。
18. 2% BSA(10X 储存液):2 g 高纯度的牛血清白蛋白溶解于 100 ml 蒸馏水中,过滤除菌,-20℃ 保存。
19. 50 mg/ml Torula yeast core RNA(10X 储存液):5 g Torula yeast core RNA 溶解于 100 ml 蒸馏水中,蛋白酶 K(0.25 mg/ml)37℃ 处理 1 h,酚:氯仿抽提,乙醇沉淀以去除污染的核酸酶。
二、操作方法
1. λ 噬菌体库的保存与操作
购买获得的 λ 噬菌体文库大多保存在 7% DMSO 中,DMSO 对噬菌体的活性没有影响,因此不必去除即可直接进行操作。若要长期储存,应将其分装成 50 μl 小份,于 -80℃ 保存,避免反复冻融,若要对文库进行稀释,则需采用 SM 缓冲液;工作样品可以在 4℃ 保存 2 个月。
在进行实验前,最好对购买的文库进行滴度检测,好的 cDNA 文库应 ≥108 pfu/ml,并且应含有 ≥104 的不同克隆,以保证所表达蛋白质的多样性。此外,还要求至少含有 75% 的重组克隆。
2. 宿主菌制备
接种单克隆宿主菌至 50 ml 含有 10 mmol/L MgSO4、0.2% 麦芽糖(MgSO4 和麦芽糖可以帮助噬菌体进入宿主菌)的 LB 培养液中,30℃ 120 r/min 振摇培养过夜,至 OD600 达 2.0。较低的温度和通气量可以保证过夜培养不会生长过度。
2000 r/min 离心 5 min 收集菌体,去除上清,用 10 mmol/L MgSO4 溶液重悬,使 OD600 介于 0.5 至 1.0 之间。一定要避免使用涡旋振荡器,但又要保证细胞完全重悬。重悬的细菌可在 4℃ 保存 1 个星期,而不出现明显的活性降低。
3. 噬菌体表达库涂板
(1) 在 20 个反应管中分别加入 1 ml MgSO4 重悬的细菌悬液和适量的噬菌体文库(约 5X104 pfu),37℃ 孵育 15~20 min,使噬菌体进入宿主菌。
(2) 在每个反应管中逐次加入 9 ml 融化的 NZY 顶层琼脂,并立即涂布 150 mm NZY 平板(融化的 NZY 顶层琼脂应冷却至 45℃ 再使用;每个反应管需在加入 NZY 顶层琼脂后立即涂板;NZY 平板需在 37℃ 预热,加入 NZY 顶层琼脂后尽快转动平板以使细菌层 分布均匀;20 个反应管的筛选总数为约 106 噬菌斑)。室温放置 10 min 使顶层琼脂凝固,倒置平板于 37℃ 孵育 3~5 h 至微小的噬菌斑出现。在孵育过程中注意不要将平板叠放以保证每块板温度一致,使噬菌斑同时出现。
4. IPTG 诱导蛋白表达及蛋白的转膜
(1) 用圆珠笔在硝酸纤维素滤膜上不与平板接触面进行标号。在孵育平板的过程中,将膜浸入 10 mmol/L IPTG 中 30 min,再放在 3 MM 滤纸上吸干 5 min,确保膜在铺到平板上时处于微湿状态。在操作中需戴手套,并使用灭菌的镊子。
(2) 将用 IPTG 预处理过的膜铺在长出噬菌斑的平板上,37°C 孵育 4 h 诱导重组蛋白的表达。
(3) 对膜和平板做好标记后(可以用大头针在不同的位置进行标记)小心取下膜,注意不要带下顶层琼脂,可以在取膜前先将平板和膜在冰箱内放置 15 min 后再取膜。将取下的膜放在 3 MM 滤纸上吸干 5 min 后浸入封闭缓冲液,平板保存于 4℃ 备用。
5. RNA 探针制备
(1) 用 T7/T3/SP6 RNA 聚合酶体外转录制备探针。通常使用 [ α-32P ] UTP 进行标记,合成的 RNA 中近 1/10 的尿嘧啶核苷酸标记了同位素。
(2) 转录后,用酚对 RNA 进行抽提,再用 50% 的含 7 mol/L 尿素的丙烯酰胺凝胶垂直电泳对探针进行纯化。放射自显影确定探针位置,切胶回收,用 HSCB 缓冲液过夜洗脱得到 RNA 探针,用酚:氯仿进行抽提并进行定量。
6. 探针与膜的共孵育
(1) 结合有噬菌体蛋白的硝酸纤维膜在封闭缓冲液中进行预杂交,37℃ 摇床孵育 1 h ( 40~50 r/min ) 封闭非特异结合位点。封闭缓冲液和杂交缓冲液均十分黏稠,操作中不仅要避免起泡,还要尽量保证与膜作用的均一。操作中所用的容器和器具都应预先处理, 避免核酸酶污染。
(2) 用 500 ml 漂洗缓冲液洗膜两次,立即转入 100 ml 加有探针 RNA 的结合缓冲液中。于室温在摇床 ( 40~50 r/min ) 上孵育 1 h。
7. 洗膜
用 250 ml 洗脱缓冲液洗膜,重复数次直至放射性本底水平降至最低。可用对应于未经噬菌体转染的细菌板的蛋白交联膜作为阴性对照。
8. 放射自显影挑取阳性克隆
将膜放在 3 MM 滤纸吸干,用保鲜膜包裹,-70℃ 放射自显影。曝光时间取决于探针的浓度和信号的强度(对于 107 cpm/ml 的探针,曝光 8~16 h 就可以观察到阳性结果)。此外,可以在蛋白转膜过程中重复一次转膜操作,得到两张对应同一块培养板的膜, 进行杂交反应。
将定影后的 X 射线片与膜、培养板进行对照,找出阳性点对应在平板上的噬菌斑的位置。从板上挑取阳性噬菌斑,分别加入 1 ml SM 缓冲液和 2 滴氯仿洗脱获取噬菌体。
9. 阳性克隆的确证
为证实所获阳性克隆的可靠性,需要进行二次筛选。从平板上过夜洗脱得到的噬菌体颗粒重新铺板,密度约为 100 mm NZY 琼脂平板有 200 个克隆,操作同前。第二次筛选的硝酸纤维素膜上的阳性克隆数应该增多,挑取单个的阳性克隆。如果需要,还可以进行第三轮筛选,这次每块平板约铺 50 个克隆。
1. 表达库:多采用 λ 噬菌体载体构建表达库,可根据需要选取载体。可购买预先制备好的表达库(Stratagenc 公司,Clontech 公司等均有售),也可以自己制备载体库。如 λgt11、λZAP 或 λORF8 等载体的多克隆位点前有 lacZ 基因,使融合蛋白能被 TPTG 诱导表达。改进型载体如 λTriplEx 可以使三个读码框都得到翻译,保证了蛋白质的表达。此外,还可以将组蛋白与 β-半乳糖苷酶融合,以便釆用蓝-白斑筛选重组体;在 λTriplEx 载体中加入 E.coli ompA 基因的 5'-UTR 可以提高重组体的稳定性。
2. 宿主菌:宿主菌一定要与库载体相对应。如 E.coli XL I-blue 可用作 λTriplEx 载体和 λZAP 载体的宿主菌。XL I-blue 菌的附加体 F' 中含有 △M15 lacZ 和 lac Iq 基因:△M15 lacZ 基因的表达可以通过 α 互补对重组克隆进行蓝-白斑筛选;lacIq 基因编码 lac 抑制子,在诱导剂 TPTG 不存在时抑制 lacZ 启动子的转录。
3. NZY 培养基:5 g NaCl,2 g MgSO4·7H2O,5 g 酵母提取物,10 g NZ胺(酪蛋白的酶促水解产物),定容至 1 L,高压灭菌后保存。
4. LB 培养基:10 g 蛋白胨,5 g 酵母提取物,10 g NaCl,定容至 1 L,调 pH 7.4,高压灭菌后保存。
5. NZY 顶层琼脂:NZY 培养基中加 0.7% 琼脂糖,高压灭菌。
6. NZY 平板:在 1 L NZY 培养基中加 15 g 琼脂粉,高压灭菌后铺板(约 70 ml/150 mm 培养皿,约 30 ml/100 mm 培养皿)。
7. 抗生素:氨芐青霉素:50 μg/ml;四环素:12.5 μg/ml。
8. SM 缓冲液:5.8 g NaCl,2 g MgSO4·7H2O,50 ml 1 mol/L Tris-HCl(pH 7.5),5 ml 2% 明胶,定容于 1 L,高压灭菌。
9. 0.5 mol/L IPTG,X-Gal(2.5 g X-Gal 溶解于 10 ml 二甲基甲酰胺中),20% 麦芽糖,均过滤除菌。
10. 硝酸纤维素膜(建议使用 supported nitnKdliilose,BA-S85,Schleicher&-Schuell 公司)。
11. 32P 标记的 RNA 探针:常规制备,以含 7 mol/L 尿素的丙烯酰胺胶垂直电泳对探针进行纯化,用 HSCB 缓冲液 [ 25 mmol/L Tris-HCl(pH 7.5 ),400 mmol/L NaCl,0.1% SDS ] 洗脱过夜。
12. 封闭缓冲液:5 mg/ml Torula yeast core RNA(Sigma 公司),10 mmol/L Tris- HCl(pH 7.8),150 mmol/L NaCl。
13. 漂洗缓冲液:10 mmol/L Tris-HCl(pH 7.8 )。
14. 结合缓冲液:10 mmol/L Tris-HCl(pH 7.8),1 mmol/L EDTA,0.02% Ficoll,0.02% 聚乙稀吡咯烷酮(polyvinylpyrrolidone,PVP),0.02% 牛血清白蛋白及预试验确定浓度的 NaCl(通常为 50 mmol/L 左右)。
15. 洗脱缓冲液:10 mmol/L Tris-HCl(pH 7.8),1 mmol/L EDTA,0.02% Ficoll,0.02% PVP,0.02% 牛血清白蛋白及预试验确定浓度的 NaCl(通常为 100 mmol/L 左右)。
16. 2% Ficoll(10X 储存液):2 g Ficoll ( type 400 ) 溶解于 100 ml 蒸馏水中,110℃ 灭菌 15 min,4℃ 可保存 1 个月。
17. 2% PVP(10X 储存液):2 g PVP(分子质量为 40000 Da)溶解于 100 ml 蒸馏水中,110°C 灭菌 15 min,4°C 可保存 1 个月。
18. 2% BSA(10X 储存液):2 g 高纯度的牛血清白蛋白溶解于 100 ml 蒸馏水中,过滤除菌,-20℃ 保存。
19. 50 mg/ml Torula yeast core RNA(10X 储存液):5 g Torula yeast core RNA 溶解于 100 ml 蒸馏水中,蛋白酶 K(0.25 mg/ml)37℃ 处理 1 h,酚:氯仿抽提,乙醇沉淀以去除污染的核酸酶。
二、操作方法
1. λ 噬菌体库的保存与操作
购买获得的 λ 噬菌体文库大多保存在 7% DMSO 中,DMSO 对噬菌体的活性没有影响,因此不必去除即可直接进行操作。若要长期储存,应将其分装成 50 μl 小份,于 -80℃ 保存,避免反复冻融,若要对文库进行稀释,则需采用 SM 缓冲液;工作样品可以在 4℃ 保存 2 个月。
在进行实验前,最好对购买的文库进行滴度检测,好的 cDNA 文库应 ≥108 pfu/ml,并且应含有 ≥104 的不同克隆,以保证所表达蛋白质的多样性。此外,还要求至少含有 75% 的重组克隆。
2. 宿主菌制备
接种单克隆宿主菌至 50 ml 含有 10 mmol/L MgSO4、0.2% 麦芽糖(MgSO4 和麦芽糖可以帮助噬菌体进入宿主菌)的 LB 培养液中,30℃ 120 r/min 振摇培养过夜,至 OD600 达 2.0。较低的温度和通气量可以保证过夜培养不会生长过度。
2000 r/min 离心 5 min 收集菌体,去除上清,用 10 mmol/L MgSO4 溶液重悬,使 OD600 介于 0.5 至 1.0 之间。一定要避免使用涡旋振荡器,但又要保证细胞完全重悬。重悬的细菌可在 4℃ 保存 1 个星期,而不出现明显的活性降低。
3. 噬菌体表达库涂板
(1) 在 20 个反应管中分别加入 1 ml MgSO4 重悬的细菌悬液和适量的噬菌体文库(约 5X104 pfu),37℃ 孵育 15~20 min,使噬菌体进入宿主菌。
(2) 在每个反应管中逐次加入 9 ml 融化的 NZY 顶层琼脂,并立即涂布 150 mm NZY 平板(融化的 NZY 顶层琼脂应冷却至 45℃ 再使用;每个反应管需在加入 NZY 顶层琼脂后立即涂板;NZY 平板需在 37℃ 预热,加入 NZY 顶层琼脂后尽快转动平板以使细菌层 分布均匀;20 个反应管的筛选总数为约 106 噬菌斑)。室温放置 10 min 使顶层琼脂凝固,倒置平板于 37℃ 孵育 3~5 h 至微小的噬菌斑出现。在孵育过程中注意不要将平板叠放以保证每块板温度一致,使噬菌斑同时出现。
4. IPTG 诱导蛋白表达及蛋白的转膜
(1) 用圆珠笔在硝酸纤维素滤膜上不与平板接触面进行标号。在孵育平板的过程中,将膜浸入 10 mmol/L IPTG 中 30 min,再放在 3 MM 滤纸上吸干 5 min,确保膜在铺到平板上时处于微湿状态。在操作中需戴手套,并使用灭菌的镊子。
(2) 将用 IPTG 预处理过的膜铺在长出噬菌斑的平板上,37°C 孵育 4 h 诱导重组蛋白的表达。
(3) 对膜和平板做好标记后(可以用大头针在不同的位置进行标记)小心取下膜,注意不要带下顶层琼脂,可以在取膜前先将平板和膜在冰箱内放置 15 min 后再取膜。将取下的膜放在 3 MM 滤纸上吸干 5 min 后浸入封闭缓冲液,平板保存于 4℃ 备用。
5. RNA 探针制备
(1) 用 T7/T3/SP6 RNA 聚合酶体外转录制备探针。通常使用 [ α-32P ] UTP 进行标记,合成的 RNA 中近 1/10 的尿嘧啶核苷酸标记了同位素。
(2) 转录后,用酚对 RNA 进行抽提,再用 50% 的含 7 mol/L 尿素的丙烯酰胺凝胶垂直电泳对探针进行纯化。放射自显影确定探针位置,切胶回收,用 HSCB 缓冲液过夜洗脱得到 RNA 探针,用酚:氯仿进行抽提并进行定量。
6. 探针与膜的共孵育
(1) 结合有噬菌体蛋白的硝酸纤维膜在封闭缓冲液中进行预杂交,37℃ 摇床孵育 1 h ( 40~50 r/min ) 封闭非特异结合位点。封闭缓冲液和杂交缓冲液均十分黏稠,操作中不仅要避免起泡,还要尽量保证与膜作用的均一。操作中所用的容器和器具都应预先处理, 避免核酸酶污染。
(2) 用 500 ml 漂洗缓冲液洗膜两次,立即转入 100 ml 加有探针 RNA 的结合缓冲液中。于室温在摇床 ( 40~50 r/min ) 上孵育 1 h。
7. 洗膜
用 250 ml 洗脱缓冲液洗膜,重复数次直至放射性本底水平降至最低。可用对应于未经噬菌体转染的细菌板的蛋白交联膜作为阴性对照。
8. 放射自显影挑取阳性克隆
将膜放在 3 MM 滤纸吸干,用保鲜膜包裹,-70℃ 放射自显影。曝光时间取决于探针的浓度和信号的强度(对于 107 cpm/ml 的探针,曝光 8~16 h 就可以观察到阳性结果)。此外,可以在蛋白转膜过程中重复一次转膜操作,得到两张对应同一块培养板的膜, 进行杂交反应。
将定影后的 X 射线片与膜、培养板进行对照,找出阳性点对应在平板上的噬菌斑的位置。从板上挑取阳性噬菌斑,分别加入 1 ml SM 缓冲液和 2 滴氯仿洗脱获取噬菌体。
9. 阳性克隆的确证
为证实所获阳性克隆的可靠性,需要进行二次筛选。从平板上过夜洗脱得到的噬菌体颗粒重新铺板,密度约为 100 mm NZY 琼脂平板有 200 个克隆,操作同前。第二次筛选的硝酸纤维素膜上的阳性克隆数应该增多,挑取单个的阳性克隆。如果需要,还可以进行第三轮筛选,这次每块平板约铺 50 个克隆。