嵌套缺失和互补寡核苷酸进行接头分区诱变
材料与仪器DNA雾水乙醇 EDTA T4 DNA连接酶 TE NaCl培养箱 水浴锅步骤1. 用Bal 31或外切核酸酶Ⅲ及S1核酸酶在质粒的目的区域产生一嵌
材料与仪器
DNA
雾水乙醇 EDTA T4 DNA连接酶 TE NaCl
培养箱 水浴锅
雾水乙醇 EDTA T4 DNA连接酶 TE NaCl
培养箱 水浴锅
步骤
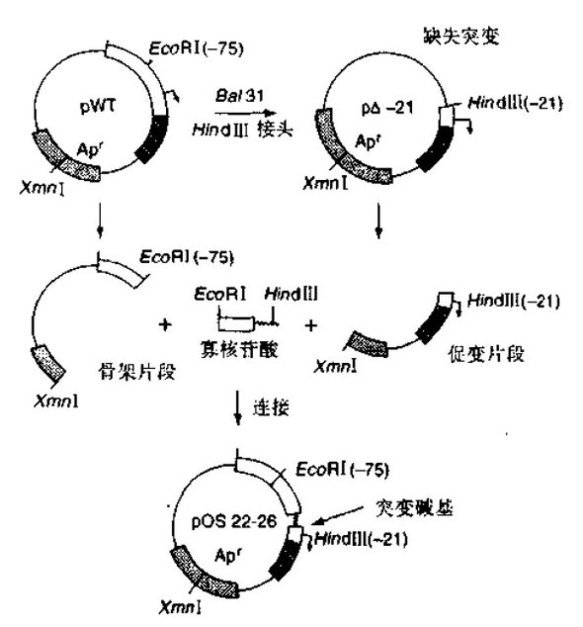
1. 用Bal 31或外切核酸酶Ⅲ及S1核酸酶在质粒的目的区域产生一嵌套式的5’或3端'缺失突变体。首先在目的序列附近用一限制酶使质粒线性化,在用Bal 31消化时,应确定其切割效率,以便弄清毎切割6~8个目的碱基对和覆盖待诱变区所需的时间。
2. 将合成接头与经适当时间酶切处理的DNA连接。用适当的限制酶进行切割以产生在缺失末端上带有接头而在另一端上含有载体位点的片段。
3. 用低熔点琼脂糖凝胶分离目的片段,将该片段与载体片段相连,以产生带缺失突变的完整质粒。
4. 用连接混合物转化合适的大肠杆菌,挑克隆,小量制备质粒DNA。
5. 用限制性内切酶消化小量制备的质粒DNA,以产生一端含缺失终点的小DNA片段,进行非变性聚丙烯酰胺或筛分型琼脂糖凝胶电泳来确定DNA片段的大小,以此说明缺失突变末端的存在。选择适当的限制性酶以便获得 200~300 bp 小片段。
6. 对目的区域内成套的缺失突变体测序,以确定准确的缺失终点。
7. 设计互补寡核苷醆,以恢复位于每一缺失末端的接头与5’系列缺失体的上游限制性酶切位点之间或者位于接头与3’系列缺失体的下游切点间的野生型序列。
3. 用低熔点琼脂糖凝胶分离目的片段,将该片段与载体片段相连,以产生带缺失突变的完整质粒。
4. 用连接混合物转化合适的大肠杆菌,挑克隆,小量制备质粒DNA。
5. 用限制性内切酶消化小量制备的质粒DNA,以产生一端含缺失终点的小DNA片段,进行非变性聚丙烯酰胺或筛分型琼脂糖凝胶电泳来确定DNA片段的大小,以此说明缺失突变末端的存在。选择适当的限制性酶以便获得 200~300 bp 小片段。
6. 对目的区域内成套的缺失突变体测序,以确定准确的缺失终点。
7. 设计互补寡核苷醆,以恢复位于每一缺失末端的接头与5’系列缺失体的上游限制性酶切位点之间或者位于接头与3’系列缺失体的下游切点间的野生型序列。
8. 制备下列片段以便与寡核苷酸相连:
(1)从每个缺失突变体上切下的一段穿过接头位点和在质粒的药物抗性标志(促变片段)内很方便的位点的片段。
(2)从野生型质粒切下来的穿过药物抗性位点和被诱变区域附近的限制性位点的骨架片段,分离这些片段。
(1)从每个缺失突变体上切下的一段穿过接头位点和在质粒的药物抗性标志(促变片段)内很方便的位点的片段。
(2)从野生型质粒切下来的穿过药物抗性位点和被诱变区域附近的限制性位点的骨架片段,分离这些片段。
9. 将每种寡核苷酸以大约100 μg/ml 的浓度重悬于含15 mmol/l NaCl 的TE缓冲液内,各种片段以等摩尔数混合,65 ℃保温10 min。
10. 慢慢冷却至室温20 min,测A260以确定浓度,取小量样品在4%的筛分型琼脂糖凝胶进行电泳监测杂交情况。
11. 将三种成分按如下方法连接起来:促变片段和骨架片段等摩尔数混合, 加摩尔数相对质粒片段50倍过量的杂交寡核苷酸,在10 μl 总体积内,DNA总量约为400 μl。加0.4 μl T4 DNA连接酶,15℃保温2 h。如在促变片段和骨架片段间通过平末端连接,应加1 μl 连接酶并在30℃保温2 h。用TE缓冲液稀释40倍至1 μg/ml。
12. 连接反应液在65℃灭活10 min,慢慢冷却至室温。
10. 慢慢冷却至室温20 min,测A260以确定浓度,取小量样品在4%的筛分型琼脂糖凝胶进行电泳监测杂交情况。
11. 将三种成分按如下方法连接起来:促变片段和骨架片段等摩尔数混合, 加摩尔数相对质粒片段50倍过量的杂交寡核苷酸,在10 μl 总体积内,DNA总量约为400 μl。加0.4 μl T4 DNA连接酶,15℃保温2 h。如在促变片段和骨架片段间通过平末端连接,应加1 μl 连接酶并在30℃保温2 h。用TE缓冲液稀释40倍至1 μg/ml。
12. 连接反应液在65℃灭活10 min,慢慢冷却至室温。
13. 用20~25 μl 稀释的连接反应液转化合适的大肠杆菌,涂布在选择培养基上,5%的连接液可产生20~30个克隆,而且所有的克隆均有正确的结构。
14. 挑克隆,小量制备质粒DNA,通过限制性酶切消化和DNA测序验证DNA。
14. 挑克隆,小量制备质粒DNA,通过限制性酶切消化和DNA测序验证DNA。
常见问题
图一、基本方案产生接头分区诱变





