用引物延伸法进行 RNA 的分析
原理引物延伸法主要用于 mRNA5' 末端作图。poly (A) + RNA 先与过量 5' 末端标记的且与靶 RNA 互补的单链寡核苷酸引物杂
原理
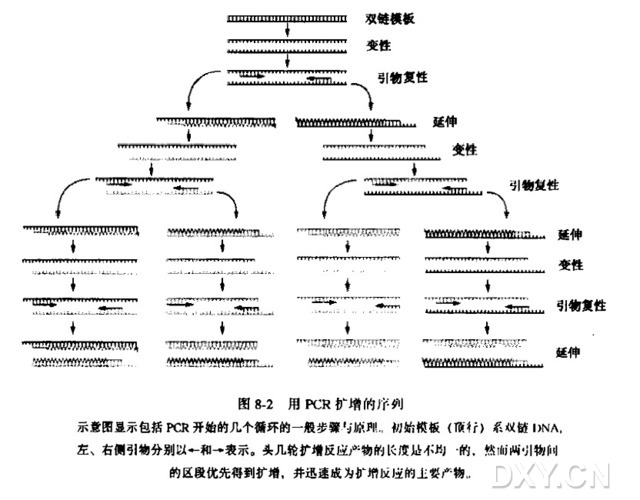
引物延伸法主要用于 mRNA5' 末端作图。poly (A) + RNA 先与过量 5' 末端标记的且与靶 RNA 互补的单链寡核苷酸引物杂交,然后用反转录酶延伸这个引物。产生的 cDNA 与 RNA 模板互补且长度与引物 5' 末端和 RNA 5' 末端之间的距离相等。
材料与仪器
多核苷酸激酶 RNA 酶蛋白质抑制剂 反转录酶 寡核苷酸引物 ATP
乙酸铵 氯仿 DTT 乙醇 甲酰胺加样缓冲液 KCl 酚 引物延伸反应混合物 乙酸钠 TE 三氯乙酸
变性聚丙烯酰胺凝胶 水浴 Whatman 3 MM 滤纸
乙酸铵 氯仿 DTT 乙醇 甲酰胺加样缓冲液 KCl 酚 引物延伸反应混合物 乙酸钠 TE 三氯乙酸
变性聚丙烯酰胺凝胶 水浴 Whatman 3 MM 滤纸
步骤
一、材料
1. 缓冲液与溶液
乙酸铵(10 mol/L)
氯仿
DTT ( 1 mol/L)
乙醇
甲酰胺加样缓冲液(80% 去离子甲酰胺,10 mmol/L EDTA (pH 8.0),1 mg/ml 二甲苯腈蓝,1 mg/ml 溴酚蓝)
KCl ( 1.25 mol/L )
酚
引物延伸反应混合物(20 mmol/L Tris-Cl(pH 8.4)(室温),10 mmol/L MgCl2,1.6 mmol/L dNTP 溶液,50 μg/ml 放线菌素 D)
乙酸钠(3 mol/L,pH 5.2)
TE ( pH 7.6)
三氯乙酸(1% 和 10% TCA )
2. 酶与缓冲液
多核苷酸激酶
RNA 酶蛋白质抑制剂
反转录酶
3. 凝胶
含 8 mol/L 尿素的变性聚丙烯酰胺凝胶
4. 核酸和寡核苷酸
载体 RNA ( 酵母 tRNA)
放射性标记的用于凝胶电泳的 DNA 相对分子质量参照物
待分析的 RNA
寡核苷酸引物
5. 放射性化合物
[γ-32P] ATP(10 mCi/ml,7000 Ci/mmol)
6. 特殊装备
42~95℃ ( 包括合适复性温度)水浴
Whatman 3 MM 滤纸(或相当产品)
二、方法
寡核苷酸探针的制备
1. 如下反应体系中使寡核苷酸磷酸化
寡核苷酸引物(5~7 pmol 或 60 ng) 1 μl
去离子水 6.5 μl
10X 激酶缓冲液 1.5 μl
多核苷酸激酶(~10 个单位) 1 μl
[λ-32P] ATP(7000 Ci/mmol) 2 μl
37℃ 温育 60 min。
2. 加入 500 ml TE ( pH 7.6) 终止反应。加入 25 μg 载体 RNA。
3. 加入 400 μl 平衡过的酚(pH 8.0) 和 400 μl 氯仿(或是 800 μl 的酚:氯仿 1:1 的混合物)。剧烈振荡 20s。离心 2 min 分离水相和有机相。
4. 把水层移至新的无菌离心管,用 800 μl 氯仿抽提,剧烈振荡 20 s。离心 2 min 分离水相和有机相。再把水层移至一新的无菌离心管中。
5. 重复步骤 4。
6. 向步骤 5 的水层加入 55 μl 无菌的 3 mol/L 乙酸钠(pH 5.2) 和 1 ml 乙醇。混匀并置于 -70℃ 至少 1 h。
7. 用最大转速离心 15 min 收集寡核苷酸引物沉淀丢弃放射性的上淸。再用 70% 乙醇洗一次,弃上清,空气中晾干沉淀。沉淀溶于 500 μl TE ( pH 7.6)。
8. 在液闪计数器的 10 ml 闪烁液中对 2 μl 放射性标记的寡核苷酸引物计数。假定 80% 回收率计算引物特异的放射活性。引物特异活性应为 2X106 cpm/pmol。
寡核苷酸引物的杂交和延伸
9. 混合 104~105 cpm ( 20~40 fmol)的 DNA 引物和 0.5~150 μg 的待分析 RNA。加入 0.1 倍体积的 3 mol/L 的乙酸钠(pH 5.2) 和 2.5 倍体积的乙醇。置于 -70℃ 60 min。用最大转速于 4℃ 离心 10 min 回收 RNA。用 70% 乙醇洗涤沉淀,再离心。小心移去乙醇,室温放置直至最后痕量的乙醇挥发尽。
10. 每管用 8 μl TE ( pH 7.6) 重悬沉淀,反复抽吸几次使之溶解。
11. 加入 2.2 μl 1.25 moI/L 的 KCl。轻轻混匀,离心 2s 使液体沉于管底。
12. 将寡核苷酸/RNA 混合物置于适当复性温度的水浴中。在通过预实验确定的最适温度下温育 15 min。
13. 在寡核苷酸和 RNA 复性时,按如下所述向引物延伸混合物中加入 DTT 和反转录酶:冰上溶解 300 μl 引物延伸混合物,然后加入 3 μl 1 mol/L 的 DTT 和终浓度为 1~2 单位/μl 的反转录酶。加入 0.1 单位/μl 的 RNA 酶的蛋白质抑制剂,倒转几次轻轻混匀,保存于冰上。
14. 从水浴中取出含有寡核苷酸引物和 RNA 的管,离心 2s 使液体沉于管底。
15. 每管加入 24 μl 引物延伸混合物。轻轻混匀,离心使液体沉于管底。
16. 42℃ 温育 1 h 使引物延伸反应进行。
17. 加入 200 μl TE(pH 7.6),100 μl 平衡酚(pH 8.0),100 μl 氯仿终止反应。振荡 20 s,室温离心 4 min 分离水相和有机相。
18. 加入 50 μl 10 mol/L 的乙酸铵和 700 μl 乙醇沉淀核酸。振荡充分混匀,-70℃ 放置至少 1 h。引物延伸产物的纯化和分析。
19. 4℃ 离心 10 min 回收沉淀核酸,小心地用 400 μl 70% 乙醇洗涤。4℃ 离心 5 min,用吸头移去 70% 乙醇洗涤液。室温开口放置直至最后可见的乙醇挥发尽。
20. 用 10 μl 甲酸胺上样缓冲液溶解核酸沉淀,反复抽吸帮助重溶。
21. 95℃ 加热样品 8 min,置于冰浴上。立即用变性聚丙烯酰胺凝胶电泳分析引物延伸产物。
22. 当示踪染料在凝胶中迁移了适当的距离后,关闭电源,打开电泳装置的盖。轻轻撬开较大玻璃板的一边,慢慢从胶上移去玻璃板。切去凝胶的一角以定方向。
23. 假如所用的聚丙烯酰胺凝胶厚 1 mm,在 TCA 中固定。把含凝胶的玻璃板移至一个含过量的 10% TCA 的托盘中,室温轻轻振动或转动托盘 10 min。
24. 倒去 10% TCA,重新加入过量的 1% TCA,室温轻轻振动或转动托盘 5 min。
25. 倒去 1% TCA,用去离子水漂洗固定过的凝胶。从托盘中一起取出玻璃板和凝胶,置于平台顶上用纸巾从边缘吸去多余的水。
26. 剪一张各边均比凝胶大 1 cm 的 Whatman 3 MM 滤纸(或相当产品)。把滤纸铺在凝胶顶上再倒转玻璃板使凝胶转移到滤纸上。
27. 移去玻璃板,用热真空凝胶干燥器于 60℃ 干燥 1.0~1.5 h。
28. 用放射自显影或磷光成像得到凝胶的图像。
1. 缓冲液与溶液
乙酸铵(10 mol/L)
氯仿
DTT ( 1 mol/L)
乙醇
甲酰胺加样缓冲液(80% 去离子甲酰胺,10 mmol/L EDTA (pH 8.0),1 mg/ml 二甲苯腈蓝,1 mg/ml 溴酚蓝)
KCl ( 1.25 mol/L )
酚
引物延伸反应混合物(20 mmol/L Tris-Cl(pH 8.4)(室温),10 mmol/L MgCl2,1.6 mmol/L dNTP 溶液,50 μg/ml 放线菌素 D)
乙酸钠(3 mol/L,pH 5.2)
TE ( pH 7.6)
三氯乙酸(1% 和 10% TCA )
2. 酶与缓冲液
多核苷酸激酶
RNA 酶蛋白质抑制剂
反转录酶
3. 凝胶
含 8 mol/L 尿素的变性聚丙烯酰胺凝胶
4. 核酸和寡核苷酸
载体 RNA ( 酵母 tRNA)
放射性标记的用于凝胶电泳的 DNA 相对分子质量参照物
待分析的 RNA
寡核苷酸引物
5. 放射性化合物
[γ-32P] ATP(10 mCi/ml,7000 Ci/mmol)
6. 特殊装备
42~95℃ ( 包括合适复性温度)水浴
Whatman 3 MM 滤纸(或相当产品)
二、方法
寡核苷酸探针的制备
1. 如下反应体系中使寡核苷酸磷酸化
寡核苷酸引物(5~7 pmol 或 60 ng) 1 μl
去离子水 6.5 μl
10X 激酶缓冲液 1.5 μl
多核苷酸激酶(~10 个单位) 1 μl
[λ-32P] ATP(7000 Ci/mmol) 2 μl
37℃ 温育 60 min。
2. 加入 500 ml TE ( pH 7.6) 终止反应。加入 25 μg 载体 RNA。
3. 加入 400 μl 平衡过的酚(pH 8.0) 和 400 μl 氯仿(或是 800 μl 的酚:氯仿 1:1 的混合物)。剧烈振荡 20s。离心 2 min 分离水相和有机相。
4. 把水层移至新的无菌离心管,用 800 μl 氯仿抽提,剧烈振荡 20 s。离心 2 min 分离水相和有机相。再把水层移至一新的无菌离心管中。
5. 重复步骤 4。
6. 向步骤 5 的水层加入 55 μl 无菌的 3 mol/L 乙酸钠(pH 5.2) 和 1 ml 乙醇。混匀并置于 -70℃ 至少 1 h。
7. 用最大转速离心 15 min 收集寡核苷酸引物沉淀丢弃放射性的上淸。再用 70% 乙醇洗一次,弃上清,空气中晾干沉淀。沉淀溶于 500 μl TE ( pH 7.6)。
8. 在液闪计数器的 10 ml 闪烁液中对 2 μl 放射性标记的寡核苷酸引物计数。假定 80% 回收率计算引物特异的放射活性。引物特异活性应为 2X106 cpm/pmol。
寡核苷酸引物的杂交和延伸
9. 混合 104~105 cpm ( 20~40 fmol)的 DNA 引物和 0.5~150 μg 的待分析 RNA。加入 0.1 倍体积的 3 mol/L 的乙酸钠(pH 5.2) 和 2.5 倍体积的乙醇。置于 -70℃ 60 min。用最大转速于 4℃ 离心 10 min 回收 RNA。用 70% 乙醇洗涤沉淀,再离心。小心移去乙醇,室温放置直至最后痕量的乙醇挥发尽。
10. 每管用 8 μl TE ( pH 7.6) 重悬沉淀,反复抽吸几次使之溶解。
11. 加入 2.2 μl 1.25 moI/L 的 KCl。轻轻混匀,离心 2s 使液体沉于管底。
12. 将寡核苷酸/RNA 混合物置于适当复性温度的水浴中。在通过预实验确定的最适温度下温育 15 min。
13. 在寡核苷酸和 RNA 复性时,按如下所述向引物延伸混合物中加入 DTT 和反转录酶:冰上溶解 300 μl 引物延伸混合物,然后加入 3 μl 1 mol/L 的 DTT 和终浓度为 1~2 单位/μl 的反转录酶。加入 0.1 单位/μl 的 RNA 酶的蛋白质抑制剂,倒转几次轻轻混匀,保存于冰上。
14. 从水浴中取出含有寡核苷酸引物和 RNA 的管,离心 2s 使液体沉于管底。
15. 每管加入 24 μl 引物延伸混合物。轻轻混匀,离心使液体沉于管底。
16. 42℃ 温育 1 h 使引物延伸反应进行。
17. 加入 200 μl TE(pH 7.6),100 μl 平衡酚(pH 8.0),100 μl 氯仿终止反应。振荡 20 s,室温离心 4 min 分离水相和有机相。
18. 加入 50 μl 10 mol/L 的乙酸铵和 700 μl 乙醇沉淀核酸。振荡充分混匀,-70℃ 放置至少 1 h。引物延伸产物的纯化和分析。
19. 4℃ 离心 10 min 回收沉淀核酸,小心地用 400 μl 70% 乙醇洗涤。4℃ 离心 5 min,用吸头移去 70% 乙醇洗涤液。室温开口放置直至最后可见的乙醇挥发尽。
20. 用 10 μl 甲酸胺上样缓冲液溶解核酸沉淀,反复抽吸帮助重溶。
21. 95℃ 加热样品 8 min,置于冰浴上。立即用变性聚丙烯酰胺凝胶电泳分析引物延伸产物。
22. 当示踪染料在凝胶中迁移了适当的距离后,关闭电源,打开电泳装置的盖。轻轻撬开较大玻璃板的一边,慢慢从胶上移去玻璃板。切去凝胶的一角以定方向。
23. 假如所用的聚丙烯酰胺凝胶厚 1 mm,在 TCA 中固定。把含凝胶的玻璃板移至一个含过量的 10% TCA 的托盘中,室温轻轻振动或转动托盘 10 min。
24. 倒去 10% TCA,重新加入过量的 1% TCA,室温轻轻振动或转动托盘 5 min。
25. 倒去 1% TCA,用去离子水漂洗固定过的凝胶。从托盘中一起取出玻璃板和凝胶,置于平台顶上用纸巾从边缘吸去多余的水。
26. 剪一张各边均比凝胶大 1 cm 的 Whatman 3 MM 滤纸(或相当产品)。把滤纸铺在凝胶顶上再倒转玻璃板使凝胶转移到滤纸上。
27. 移去玻璃板,用热真空凝胶干燥器于 60℃ 干燥 1.0~1.5 h。
28. 用放射自显影或磷光成像得到凝胶的图像。