解链温度的实验测定
材料与仪器变性液 中和缓冲液 寡核苷酸预杂交液 酚: 氯仿 乙酸钠 SSC 酶切双链靶 DNA 的适当的限制酶 对照 DNA 靶 DNA 寡核苷酸探针煮沸水浴装
材料与仪器
变性液 中和缓冲液 寡核苷酸预杂交液 酚: 氯仿 乙酸钠 SSC 酶切双链靶 DNA 的适当的限制酶 对照 DNA 靶 DNA 寡核苷酸探针
煮沸水浴装置 交联仪器、微波炉或真空炉平头镊子 玻璃试管 硝酸纤维素或尼龙膜 穿纸打孔器 闪烁杯 溫度计 厚吸水纸 精确控温循环水浴装置
煮沸水浴装置 交联仪器、微波炉或真空炉平头镊子 玻璃试管 硝酸纤维素或尼龙膜 穿纸打孔器 闪烁杯 溫度计 厚吸水纸 精确控温循环水浴装置
步骤
材料
溶液和缓冲液
稀释贮存液至适当浓度。
变性液(仅适用于双链靶 DNA)
1.5mol/L NaCl
0.5mol/LNaOH
中和缓冲液(仅适用于双链靶 DNA)
0.5mol/LTris-Cl(pH7.4)
1.5mol/LNaCl
寡核苷酸预杂交液
6XSSC(或 6XSSPE)
0.01mol/L 磷酸钠(pH6.8)
1 mmol/LEDTA(pH8.0)
5xDenherdt's 溶液
0.5%(m/V)SDS
100ug/ml 变性、片段化的鮭精 DNA(见第 6 章的方案 10)
酚: 氯仿(1:1,V/V)(仅适用于双链靶 DNA)
乙酸钠(3mol/L,pH5.2)(仅适用于双链靶 DNA)
2XSSC
酶与缓冲液
酶切双链靶 DNA 的适当的限制酶
见步骤 3。
核酸与寡核苷酸
对照 DNA
与靶 DNA 序列无关的单链或双链 DNA 载体,见步骤 3。
靶 DNA
理想的靶 DNA 应克隆于 M13 噬菌体载体并提纯为单链 DNA(见第 13 章)。双链质粒 DNA 或 PCR 产物也能按本方案的步骤 3 所述变性后使用。
探针
寡核苷酸探针
如磷酸化标记的探针比活度大于 106cpm/ug,未纯化的寡核苷酸也可用于本实验。
合成探针之前,应对探针与用于克隆靶基因的載体之间可能存在的同源和/或互补序列进行检查。绝大多数商用 DNA 分析软件可用于常用载体序列的匹配性研究,以避免杂交过程中出现问题。
专用设备
煮沸水浴装置
交联仪器(Stratalinker、Stratagene 公司;GS Gene Linker、Bio-Rad 公司)、微波炉或真空炉平头镊子
玻璃试管(17X100 mm)
硝酸纤维素或尼龙膜
穿纸打孔器
闪烁杯,每一个闪烁杯含 10 ml 水溶性闪烁体
溫度计
厚吸水纸("Whatman3 MM,Schleicher&SchuellGB004, 或 Sigma QuickDraw)
精确控温循环水浴装置
见步骤 7、10、12。
附加试剂
本方案步骤 1 所需的试剂列于本章方案 2 和方案 4。
方法
1. 磷酸化方法(方案 2) 放射性标记 1~10pmol 的寡核苷酸用作探针,并用 CPB 沉淀法除去过量未掺入的 [y-32P]ATP(方案 4)。
2. 用穿纸打孔器在硝酸纤维素膜或尼龙膜上打孔,制成四张圆形小滤膜(直径为 3~4 mm)。将小膜片排列在一张 Parafilm 膜上,用软铅笔标记其中二张滤膜。
3. 按下列方式将靶 DNA 与对照 DNA 点到滤膜上:
单链靶 DNA
a. 将约 100ng 靶 DNA 溶于1~3ul2XSSC 中,点在每张标记的滤膜上。
b. 在未作标记的滤膜上点等量的载体 DNA(无插入序列的 M13 噬菌体单链 DNA)。
c. 待液体干后,用平头镊子(如 Millipore 镊子)把两组滤膜从 Parafilm 膜上取下,置于厚滤纸之间。
d. 在真空炉内 80°C 烘烤 1~2 h, 使 DNA 固定在膜上。
亦可把滤膜放在滤纸上,用紫外光照射偶联使 DNA 固定。
双链靶 DNA
a. 如果靶 DNA 已克隆于质粒,用在靶序列上无切点的限制性内切核酸酶消化重组质粒和载体,使其线性化。
b. 用酚: 氯仿抽提及标准乙醇沉淀纯化所获双链 DNA 或 PCR 产物。用 2XSSC 将 DNA 溶解成 50~100ng/ul 溶液。
c. 将靶 DNA 与对照 DNA 点到上述准备好的滤膜上,用平头镊子把滤膜移至浸透变性溶液的厚滤纸上,室温温育 10 min。
d. 将滤膜移至浸透中和液的厚滤纸上,室温温育 10 min。
e. 将膜片移至一张新的干燥的厚滤纸上,于室温下放置直到液体全部挥发。在真空炉内 80°C 烘烤 1~2 h, 或用紫外光照射偶联,使 DNA 固定在膜上。
4. 用平头镊子把所有滤膜移至盛有 2 ml 寡核苷酸预杂交液的聚丙稀反应管中,封好管口,在低于所用溶液的 Tm 值 25°C 的条件下温育,不时揺动。
上述方案适用于含钠盐的杂交液,如准备测定溶剂中的 Ti 值,也可用其他溶液如 TMAC1 或 TEAC1 取代钠盐。
5.2 h 后,将放射性标记的寡核苷酸加至预杂交液内。寡核苷酸的终浓度应为约 1pmol/ml。继续在低于值 25°C 的温度下温育 2~4 h, 不时摇动。
6. 从杂交液中取出滤膜,将其立即在室温下浸入 2XSSC, 不停揺动溶液。每隔 5 min 更换一次溶液,直到滤膜的放射活度不再变化(用手提式探测仪检测)。
7. 调整循环水浴温度至低于 Tm 值 25°C, 在 20 支玻璃试管(17xl00 mm)中各加入 5 ml2xSSC 溶液。用温度计测量试管内的温度,将所有试管置于水浴中,直到 2XSSC 溶液达到低于 Tm 值 25°C 的温度。
8. 将滤膜分别放入 4 支空玻璃试管中,各加入 1 ml2XSSC 溶液(步骤 7 准备的并预温至低于 Tm 值 25°C), 放置在循环水浴中温育 5 min。
9. 从水浴中取出试管,将管中液体移至闪烁瓶,室温下用 lml2XSSC 溶液洗涤玻璃管及管内的滤膜,并将洗液加入对应的闪烁瓶中。
10. 将水浴温度提高 3°C,等待步骤 7 准备的 2xSSC 溶液与之平衡。
11. 将 1 ml 此温度下的 2XSSC 溶液加至含滤膜的 4 支试管内,并将试管置水浴中 5 min。
12. 不断提高温度,重复步骤 9、10、11, 直至达到高于 Tm 值 30°C。
13. 将 4 块膜片分别置于含有1ml 2XSSC 溶液的 4 支玻璃试管(17X100 mm) 中,加热煮沸 5 min, 以除去所有残余的放射性。将溶液在冰上冷却,并将液体移至闪烁瓶。用 lml2XSSC 溶液洗涤煮沸的试管及滤膜,将洗液加入对应的闪烁瓶内。
14. 用液体闪烁仪测量所有闪烁瓶的放射性活度(用切仑科夫计数,见附录 8)。用下列公式计算不同温度下洗脱的总放射性活度所占的比例。
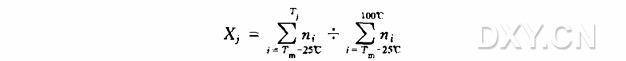
式中 Xj 为在温度下洗脱的总放射性部分,ni 为 i=Tj 时洗脱的放射性活度,Tj 表示从低于 Tm 值 25°C 到高于 Tm 值 30°C 的温度。
如果实验进行良好,仅含载体 DNA 的滤膜的放射性应很低。在温度远低于估计的 Tm 时,此少量放射性应从膜上完全释放。而大量的放射性应结合于含靶 DNA 的滤膜上,放射性的洗脱呈陡峭的温度依赖性。在达到临界温度以前,几乎无放射性从膜上释放,而在超过临界温度 6~9°C 时,约 90% 的放射性应释放出来。
50% 放射性从含有靶序列的滤膜上洗脱的温度定义为探针与靶序列牵文体的 Ti。
溶液和缓冲液
稀释贮存液至适当浓度。
变性液(仅适用于双链靶 DNA)
1.5mol/L NaCl
0.5mol/LNaOH
中和缓冲液(仅适用于双链靶 DNA)
0.5mol/LTris-Cl(pH7.4)
1.5mol/LNaCl
寡核苷酸预杂交液
6XSSC(或 6XSSPE)
0.01mol/L 磷酸钠(pH6.8)
1 mmol/LEDTA(pH8.0)
5xDenherdt's 溶液
0.5%(m/V)SDS
100ug/ml 变性、片段化的鮭精 DNA(见第 6 章的方案 10)
酚: 氯仿(1:1,V/V)(仅适用于双链靶 DNA)
乙酸钠(3mol/L,pH5.2)(仅适用于双链靶 DNA)
2XSSC
酶与缓冲液
酶切双链靶 DNA 的适当的限制酶
见步骤 3。
核酸与寡核苷酸
对照 DNA
与靶 DNA 序列无关的单链或双链 DNA 载体,见步骤 3。
靶 DNA
理想的靶 DNA 应克隆于 M13 噬菌体载体并提纯为单链 DNA(见第 13 章)。双链质粒 DNA 或 PCR 产物也能按本方案的步骤 3 所述变性后使用。
探针
寡核苷酸探针
如磷酸化标记的探针比活度大于 106cpm/ug,未纯化的寡核苷酸也可用于本实验。
合成探针之前,应对探针与用于克隆靶基因的載体之间可能存在的同源和/或互补序列进行检查。绝大多数商用 DNA 分析软件可用于常用载体序列的匹配性研究,以避免杂交过程中出现问题。
专用设备
煮沸水浴装置
交联仪器(Stratalinker、Stratagene 公司;GS Gene Linker、Bio-Rad 公司)、微波炉或真空炉平头镊子
玻璃试管(17X100 mm)
硝酸纤维素或尼龙膜
穿纸打孔器
闪烁杯,每一个闪烁杯含 10 ml 水溶性闪烁体
溫度计
厚吸水纸("Whatman3 MM,Schleicher&SchuellGB004, 或 Sigma QuickDraw)
精确控温循环水浴装置
见步骤 7、10、12。
附加试剂
本方案步骤 1 所需的试剂列于本章方案 2 和方案 4。
方法
1. 磷酸化方法(方案 2) 放射性标记 1~10pmol 的寡核苷酸用作探针,并用 CPB 沉淀法除去过量未掺入的 [y-32P]ATP(方案 4)。
2. 用穿纸打孔器在硝酸纤维素膜或尼龙膜上打孔,制成四张圆形小滤膜(直径为 3~4 mm)。将小膜片排列在一张 Parafilm 膜上,用软铅笔标记其中二张滤膜。
3. 按下列方式将靶 DNA 与对照 DNA 点到滤膜上:
单链靶 DNA
a. 将约 100ng 靶 DNA 溶于1~3ul2XSSC 中,点在每张标记的滤膜上。
b. 在未作标记的滤膜上点等量的载体 DNA(无插入序列的 M13 噬菌体单链 DNA)。
c. 待液体干后,用平头镊子(如 Millipore 镊子)把两组滤膜从 Parafilm 膜上取下,置于厚滤纸之间。
d. 在真空炉内 80°C 烘烤 1~2 h, 使 DNA 固定在膜上。
亦可把滤膜放在滤纸上,用紫外光照射偶联使 DNA 固定。
双链靶 DNA
a. 如果靶 DNA 已克隆于质粒,用在靶序列上无切点的限制性内切核酸酶消化重组质粒和载体,使其线性化。
b. 用酚: 氯仿抽提及标准乙醇沉淀纯化所获双链 DNA 或 PCR 产物。用 2XSSC 将 DNA 溶解成 50~100ng/ul 溶液。
c. 将靶 DNA 与对照 DNA 点到上述准备好的滤膜上,用平头镊子把滤膜移至浸透变性溶液的厚滤纸上,室温温育 10 min。
d. 将滤膜移至浸透中和液的厚滤纸上,室温温育 10 min。
e. 将膜片移至一张新的干燥的厚滤纸上,于室温下放置直到液体全部挥发。在真空炉内 80°C 烘烤 1~2 h, 或用紫外光照射偶联,使 DNA 固定在膜上。
4. 用平头镊子把所有滤膜移至盛有 2 ml 寡核苷酸预杂交液的聚丙稀反应管中,封好管口,在低于所用溶液的 Tm 值 25°C 的条件下温育,不时揺动。
上述方案适用于含钠盐的杂交液,如准备测定溶剂中的 Ti 值,也可用其他溶液如 TMAC1 或 TEAC1 取代钠盐。
5.2 h 后,将放射性标记的寡核苷酸加至预杂交液内。寡核苷酸的终浓度应为约 1pmol/ml。继续在低于值 25°C 的温度下温育 2~4 h, 不时摇动。
6. 从杂交液中取出滤膜,将其立即在室温下浸入 2XSSC, 不停揺动溶液。每隔 5 min 更换一次溶液,直到滤膜的放射活度不再变化(用手提式探测仪检测)。
7. 调整循环水浴温度至低于 Tm 值 25°C, 在 20 支玻璃试管(17xl00 mm)中各加入 5 ml2xSSC 溶液。用温度计测量试管内的温度,将所有试管置于水浴中,直到 2XSSC 溶液达到低于 Tm 值 25°C 的温度。
8. 将滤膜分别放入 4 支空玻璃试管中,各加入 1 ml2XSSC 溶液(步骤 7 准备的并预温至低于 Tm 值 25°C), 放置在循环水浴中温育 5 min。
9. 从水浴中取出试管,将管中液体移至闪烁瓶,室温下用 lml2XSSC 溶液洗涤玻璃管及管内的滤膜,并将洗液加入对应的闪烁瓶中。
10. 将水浴温度提高 3°C,等待步骤 7 准备的 2xSSC 溶液与之平衡。
11. 将 1 ml 此温度下的 2XSSC 溶液加至含滤膜的 4 支试管内,并将试管置水浴中 5 min。
12. 不断提高温度,重复步骤 9、10、11, 直至达到高于 Tm 值 30°C。
13. 将 4 块膜片分别置于含有1ml 2XSSC 溶液的 4 支玻璃试管(17X100 mm) 中,加热煮沸 5 min, 以除去所有残余的放射性。将溶液在冰上冷却,并将液体移至闪烁瓶。用 lml2XSSC 溶液洗涤煮沸的试管及滤膜,将洗液加入对应的闪烁瓶内。
14. 用液体闪烁仪测量所有闪烁瓶的放射性活度(用切仑科夫计数,见附录 8)。用下列公式计算不同温度下洗脱的总放射性活度所占的比例。
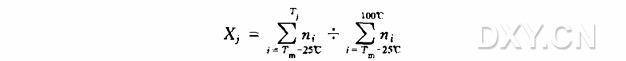
式中 Xj 为在温度下洗脱的总放射性部分,ni 为 i=Tj 时洗脱的放射性活度,Tj 表示从低于 Tm 值 25°C 到高于 Tm 值 30°C 的温度。
如果实验进行良好,仅含载体 DNA 的滤膜的放射性应很低。在温度远低于估计的 Tm 时,此少量放射性应从膜上完全释放。而大量的放射性应结合于含靶 DNA 的滤膜上,放射性的洗脱呈陡峭的温度依赖性。在达到临界温度以前,几乎无放射性从膜上释放,而在超过临界温度 6~9°C 时,约 90% 的放射性应释放出来。
50% 放射性从含有靶序列的滤膜上洗脱的温度定义为探针与靶序列牵文体的 Ti。




