GST pull-down技术原理及常见问题分析
Pull-down技术是通过以适当标签和目的基因进行融合表达作为诱饵,从细胞提取物中钓出与目的蛋白相互作用的蛋白。多组分蛋白质复合物的分离主要利用固定在琼脂糖树脂的反标签系统完成(表1)。
1988年Smith等利用谷胱甘肽-S-转移酶(glutathione-transferase,GST)融合标签从细菌中一步纯化出GST融合蛋白。从此,GST融合蛋白在蛋白质相互作用研究领域里得到了极大的推广。
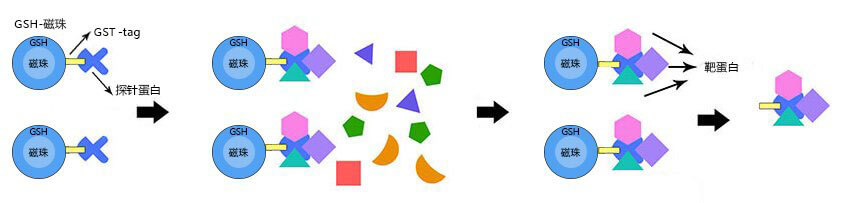
GST pull-down技术原理
GST融合蛋白pull-down方法是将诱饵蛋白质和GST标签融合表达,一步纯化后与含有目的蛋白质的溶液进行孵育,利用谷胱甘肽-Sepharose将GST-融合蛋白-目的蛋白复合物沉淀下来,然后进行SDS-PAGE鉴定与诱饵蛋白质相互作用的蛋白质。一般来说,GST融合蛋白pull-down方法用于两个方面:一是鉴定能与已知融合蛋白质相互作用的未知蛋白质;一是鉴定两个已知蛋白质之间是否存在相互作用。该方法比较简便,在蛋白质相互作用研究中有很广泛的应用。
GST pull-down技术常见问题
GST pull-down技术在体外验证蛋白间直接的相互作用时有较强的特异性,但也存在一定的局限性。GST pull-down技术不能用于大规模的蛋白间相互作用的筛查;内源性蛋白的干扰使实验结果出现假阳性。因此要求在实验中充分考虑可能对实验结果造成影响的因素,以减少假阳性的出现。在进行GST-pulldown 实验时应该考虑以下几点。
1.高纯度GST融合蛋白的获得
高纯度的融合蛋白能减少实验结果的假阳性,因此获得高纯度的融合蛋白对于GST pull-down 实验的结果分析具有重要的作用。同时,为了能最大程度地保证融合蛋白原有的生物学活性,一般倾向于可溶性融合蛋白。德泰生物提供哺乳动物细胞瞬时转染服务,可在短期内获得可溶性蛋白,通过基因序列优化,自主研发的高表达载体,结合丰富的细胞转染经验,蛋白表达产量可达毫克至克级别。
2. GST标签对实验结果的影响
虽然在大多数情况下认为GST标签不会对下游蛋白的折叠和功能造成影响,但实际上GST标签有可能会影响蛋白的正确折叠。因此对融合蛋白进行质量控制,会使实验结果更加可信。例如对标签蛋白用核磁共振的方法进行检测,以确定其结构是否发生变化,或者是应用X射线晶体分析法检测标签蛋白结构上有无变化,再者就是结合其他的已知能发生相互作用的蛋白来对标签蛋白进行功能上的验证,以检测其结构或功能是否发生了变化,这些方法均可提高结果的可信度。
3.DNA和RNA对实验结果的影响
有研究在利用GST pull-down检测蛋白间是否存在相互作用关系时,对阳性结果进一步探究发现,两种蛋白均为DNA结合蛋白,两者相互作用是两种蛋白分别与DNA结合所致。因此,在做pull-down实验时,可加入核酸酶来消除可能桥接到蛋白上的DNA和RNA,减少蛋白间相互作用出现的假阳性。
Detaibio GST pull-down检测设置多组对照,充分排除干扰因素,结果判断更加精准;实验重复进行两次,排除随机因素影响,实验结果更加可靠,拥有完整的下游配套,可以利用BL技术进行进一步定量分析;使用银染技术,灵敏度为考马斯亮蓝100倍,SDS-PAGE电泳结果更加清晰可以提供从GST蛋白制备到蛋白互作检测的一站式服务,让您更加的省心。