IHC-让肿瘤原形毕露 【新手入门】
免疫组化是否能用于分辨肿瘤是良性还是恶性。
虽然我们可以做免疫组化实验(而且做得很好),但如果病患想通过免疫组化鉴别肿瘤,来出具具有司法效应的诊断报告。交给不具备司法权限的任何机构来做是不可行的哟~
事实上,免疫组化在医学上用于检测人体组织或细胞标本,确实可鉴别疾病或肿瘤。进而评估增生细胞来源,检测其克隆性,研究肿瘤组织代谢改变,让肿瘤组织在显微镜下原形毕露,从而达到对某些肿瘤有确诊和指导治疗的作用。
免疫组化技术不仅在临床检测上有重要的作用,在科研实验和论文中也是一个得力好助手哦。下面我们就来好好了解一下免疫组化有关的知识吧。
免疫组织化学(Immunohistochemistry,简称IHC),是指带显色剂标记的特异性抗体在组织细胞原位通过抗原抗体反应和组织化学的呈色反应,对相应抗原进行定性、定位、定量测定的一项技术。
临床应用:
1. 鉴定病变性质,恶性肿瘤的诊断和鉴别;
2. 确定转移性恶性肿瘤的原发部位;
3. 了解肿瘤的分化程度,对某类肿瘤进行病理分型;
4. 明确软组织肿瘤的正确组织学分类,明确软组织的诊断;
5. 发现微小转移灶;
6. 为临床治疗方案提供支持。
我们先来看一下实验操作有哪几步
首先,脱蜡与水化
目的是确保抗体等其他试剂能够充分与组织中抗原等结合发生反应,
若脱蜡和水化不全,易出现局灶性反应和浸洗不全,而造成非特异性背景着色;
封闭内源性过氧化物酶
主要目的是降低内源性过氧化物酶活性,要知道,在传统的ABC法和SP法中,IHC反应结果容易受到内源性过氧化物酶干扰,所以必须用过氧化氢进行灭活;
具体操作如下:
1. 放入3%过氧化氢水溶液中,室温下10min;
2. PBS溶液洗2次x5 min或者PBS溶液洗3次x3 min
抗原修复
目的是暴露抗原决定簇,
因为组织中部分抗原在甲醛或多聚甲醛固定过程中,发生了蛋白之间交联和醛基的封闭作用,从而失去抗原性,因而需要通过抗原修复,使细胞内抗原决定簇重新暴露,提高抗原检测率。
常用修复方法(由强到弱):高压修复>微波修复>胰酶修复
封闭特异性蛋白
目的是避免组织切片上剩余某些位点与一抗非特异性结合,避免因此造成结果出现假阳性;
注意:封闭血清一般是和二抗同一来源的。
一抗孵育
一抗可以通过特异性结合底物,识别出我们想要检测的东西
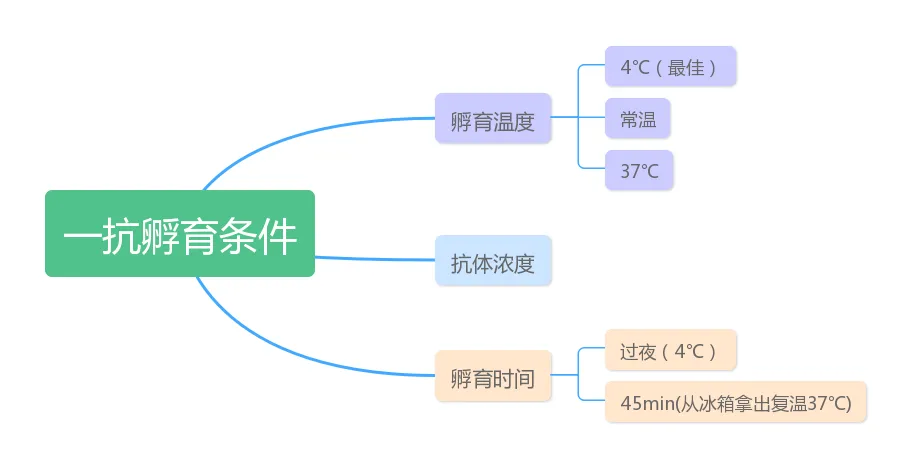
一般4℃过夜和从冰箱拿出37℃复温45min。
一是防止脱片;
二是使抗原抗体结合更稳定;
具体条件还在做更多地摸索。
二抗孵育
作用是检测一抗。二抗可以和一抗结合,并带有可以被检测出的标记(如带荧光、放射性、化学发光或显色基因)
二抗孵育条件:一般室温或37℃下孵育20min~1h,具体时间还在做更多地摸索。
实验过程中我们通常先把二抗浓度和孵育时间先定下,然后摸索一抗浓度和孵育时间。
SP反应
SP染色法即链霉素抗生物素过氧化酶连接法,为后面的显色做准备。
显色
在免疫组化中,因为抗原抗体所形成的复合物本身没有颜色不能直接观察,只能借助于其他某些化学基团的显色作用使复合物显色,有利于显微镜下观察。
而通常在过氧化物酶(HRP)法中,显色剂为DAB。
复染、脱水、透明、封片
复染目的是形成细胞轮廓,从而更好地对目标蛋白进行定位,常用试剂为苏木素。复染完后流水振洗,然后置于盐酸酒精中数秒(注意动作一定要快),之后拿出继续流水振洗,放入氨水中返蓝即可。
封片用中性树胶。
所谓“细节决定成败”,IHC的实验流程并不难,但是过程中容易遇到各种问题,要做出漂亮的实验结果也不是一件容易的事,接下来我们来看看实验结果通常反映出来的问题有哪些,如何判断呢?
IHC染色常见问题
1. 所有切片呈阴性反应:
a. 缓冲液内含叠氮化钠,抑制酶的活性;
b. 染色未完全按照操作步骤进行;
c. 漏加一种抗体或抗体失活;
d. 复染或脱水剂使用不当;
e. 底物中加入的过氧化氢少或失活。
2. 所有切片呈阳性反应:
a. 缓冲液配置中未加氯化钠和PH值不准确,洗涤不彻底;
b. 使用已变色的呈色底物溶液,或呈色反应时间过长;
c. 过氧化氢浓度过高,呈色速度过快且粘附剂太厚;
d. 切片在染色过程中抗体过浓,或干片了;
e. 抗体孵育的时间过长。
3. 切片背景过深:
a. 漂洗不够;
b. 切片或涂片过厚;
c. 蛋白质封闭不够或所用血清溶血;
d. 使用全血清抗体稀释不够;
e. 底物成色反应过久。
4. 阳性对照染色良好,检测的阳性标本呈阴性反应:
以上问题就需要我们抓好平时实验操作的每一步,尤其是注意事项,避免出现不必要的变量影响实验结果。
欢迎各位有实验外包需要的老师们前来咨询哦~
相关文章
- Imaging Techniques in Signal Transduction IHC
- Practical Considerations of Image Analysis and Quantification of Signal Transduction IHC Staining
- Immunohistochemistry (IHC) is a routinely used technique in clinical diagnosis of pathological condi
- 免疫组化/IHC实验操作步骤
- 免疫组化/IHC实验操作注意事项
- 免疫组化(IHC)染色常见问题及其解决方法 上
- 免疫组化/IHC染色常见问题及其解决方法 下
- IHC、ELISA 与 WB 实验之间的区别?