可控表达 GH 转基因猪制备技术
简介
可控表达 GH 转基因猪制备技术,由于畜禽生物育种和人类重大疾病的动物模型研究需要我们利用现代基因工程技术同时对一个动物基因组的两个或两个以上基因进行修饰,复合性状基因修饰技术已成为基因工程技术发展的主要方向之一。动物的特性往往不是由一个基因决定的,特定经济性状可能与多个基因相关;或者在实际生产中,需要基因工程动物具有两种或两种以上的基因特性。目前的动物基因工程方法每次转基因只整合一个目的基因,进而制备表达单基因的基因工程动物。如果涉及制备多基因复合性状的基因工程动物,则需单独制备相应的单基因基因工程动物,然后通过基因工程动物间的交配等方法制备转多基因动物的后代,这种制备多基因动物的方法费时、费力而且耗费高。生产实际中多基因复合性状转基因动物更具用价值。
原理
可控表达 GH 转基因猪制备技术的基本原理:
生长激素(GH)是由脑垂体前叶分泌的一种多肽激素,其作为动物生长轴的中心环节调节动物机体的生长。GH 在动物发育和家畜生产中可以促进脂肪分解、提高肉质,在生产中有很广泛的应用前景。在 GH 转基因猪的制备过程中,引入并改造了 Tet-on 调控表达系统,实现外源 GH 基因表达的安全、可控。目前,基于可控表达技术制备的 GH 转基因猪已经具有一定的群体规模,且目标性状鉴定结果表明,该育种新材料具有良好的高瘦肉率表型。
用途
可控表达 GH 转基因猪制备技术可用于培育优良转基因猪新品种的应用。
材料与仪器
器材:PCR 仪、荧光定量 PCR 仪
试剂:
① DMEM+10% 的胎牛血清(FBS)细胞培养基
② 设计引物
③ 强力霉素
④ 表达载体
⑤ 强力霉素
步骤
可控表达 GH 转基因猪制备技术的基本过程可分为如下几步:
(一)流程一
载体构建:
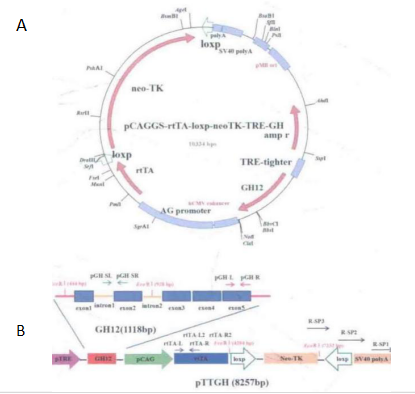
对传统的 Tet-on 诱导表达载体进行改造,将调控系统-rtTA 及可诱导表达载体系统-TRE 构建到同一个载体上,大大提高操作效率;并将 GH 基因插到可诱导表达载体系统 pTRE 及调控系统 rtTA 之间,实现对 GH 基因的可控表达(图 3-15)。
(二)流程二
阳性细胞鉴定:
采用 G418 对阳性细胞进行富集,细胞培养基为 DMEM+10% 的胎牛血清(FBS)。所获得的阳性细胞在 DNA 水平检测 rtTA 基因,检测引物为
rtTA-L:CATTCCGCTGTGCTCTCCTCTC,
rtTA-R: GAGCGTCAGCAGGCAGCATATC。
为了检测诱导前后 GH 基因和 rtTA 基因的表达情况,收集强力霉素(doxycycline,Dox)诱导前后阳性细胞株,进行 RNA 提取,采用 RT-PCR 方法对其表达量进行检测。定量引物如下:
rtTA-L:TACACTGGGCTGCGTATTGGAG,
rtTA-R:ATCGGCTGGGAGCATGTCTAAG,
pGH-L:GGGCAGGACAGATCCTCAAG,
pGH-R:GACCCGCAGGTATGTCTCAG,
PGAPDH-L:AGCAATGCCTCCTGTACCAC,
pGAPDH-R:AAGCAGGGATGATGTTCTGG。
图 3-15 可控表达 GH 基因载体图
采用 Western blot 方法检测 GH 基因的表达量。
(三)流程三
拷贝数及插入位点分析:
采用实时荧光定量 PCR(Quantitative real time PCR,QRT-PCR)方法对阳性细胞株的拷贝数进行分析。目的基因 GH 的引物及内参基因 TFRC(transferrin receptor gene)的引物信息如下:
pGH-L:GGGCAGGACAGATCCTCAAG,
pGH-R:GACCCGCAGGTATGTCTCAG,
pTFRC-L:GAGACAGAAACTTTCGAAGC,
pTFRC-:GAAGTCTGTGGTATCCAATCC。
采用基因组步移(genome walking)的方法对外源基因的插入位点进行检测,相关引物信息如下:
R-SP1:CCGGATACCTGTCCGCCTTTCTC,
R-SP2:GTGGCGCTTTCTCATAGCTCACG,
R-SP3:TGCGCCTTATCCCGGTAACTATCG。
扩增产物经胶回收后连接 T 载体并进行测序。
(四)流程四
转基因猪的制备:
采用体细胞核移植的方法进行制备。
(五)流程五
目标性状测定:
对原代转基因猪进行扩繁,对获得的 F1 代个体进行目标性状测定。实验分为 4 组:转基因 DOX 诱导组(13 公 7 母),转基因非 DOX 诱导组(10 公 6 母),非转基因猪 DOX 诱导组(8 公 8 母),非转基因猪非 DOX 诱导组(8 公 8 母)。
DOX 于仔猪 65 日龄时按照 5 mg/kg 体重进行添加,每 10 天称量一次体重。
将 F1 代转基因猪和阴性对照组共计 32 头,分为 4 组,分组同上,每组公母各 4 头,进行屠宰性能测定。