Southern blot技术
原理具有一定同源性的两条核酸单链在一定的条件下,可按碱基互补的原则特异性地杂交形成双链。利用琼脂糖凝胶电泳分离经限制性内切酶消化的DNA片段,将胶上的DNA变性
原理
具有一定同源性的两条核酸单链在一定的条件下,可按碱基互补的原则特异性地杂交形成双链。利用琼脂糖凝胶电泳分离经限制性内切酶消化的DNA片段,将胶上的DNA变性并在原位将单链DNA片段转移至尼龙膜或其他固相支持物上,经干烤或者紫外线照射固定,再与相对应结构的标记探针进行杂交,用放射自显影或酶反应显色,从而检测特定DNA分子的含量。
Southern印迹杂交技术包括两个主要过程:一是将待测定核酸分子通过一定的方法转移并结合到一定的固相支持物(硝酸纤维素膜或尼龙膜)上,即印迹(blotting);二是固定于膜上的核酸与同位素标记的探针在一定的温度和离子强度下退火,即分子杂交过程。
材料与仪器
基因组DNA PCR产物
EcoR l 反应buffer TBE DNA landing buffer 变性液 SSC转移液 Washing buffer detection buffer maleic acid buffer
eppendorf 管 Tip头 PCR仪 无粉手套 水平电泳仪 转移槽 尼龙膜 吸水纸及滤纸
EcoR l 反应buffer TBE DNA landing buffer 变性液 SSC转移液 Washing buffer detection buffer maleic acid buffer
eppendorf 管 Tip头 PCR仪 无粉手套 水平电泳仪 转移槽 尼龙膜 吸水纸及滤纸
步骤
1. 基因组DNA限制性内切酶酶切
(1)设置50 ul 反应体系,在200 ul EP管中加入:
| 10 ug 基因组DNA | x ul |
| 去离子水 | 49-x ul |
| 10×buffer | 5 ul |
| EcoR Ⅰ | 4 ul |
(2)充分混匀,离心20 s。
(3)置于PCR议上37℃反应过夜。
(4)加1/10体积乙酸钠、2体积无水乙醇沉淀DNA晾干。
(5)加20 ul TE buffer溶解DNA。
2. DNA琼脂糖凝胶电泳
(1)用0.5xTBE buffer配制0.8%琼脂糖凝胶,微波炉加热至溶化,加入EB(0.5 ug/ml)混匀后倒入制胶器中室温凝固。
(2)凝固后,去除样品梳及胶带,置于水平电泳仪中。
(3)将DNA样品用6xDNA landing buffer 混匀后加入样品孔中,恒压电泳(20 V/10 mA)直至染料电泳至边缘。
(4)电泳完毕,取出凝胶切角并在凝胶成像系统成像记录。
3. DNA转移与固定
(1)凝胶置于0.25 M HCl中处理30 min,去离子水洗1次。
(2)碱变性:凝胶置于0.4 M NaOH变性液中作用20 min。
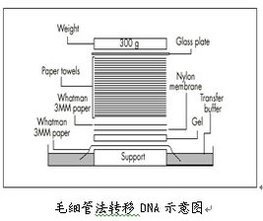
(3)毛细管法转移:根据凝胶大小裁剪与其等大小尼龙膜、滤纸片,尼龙膜一角软铅笔作方位标记。
(4)去离子水浸泡尼龙膜、滤纸片,中再浸泡5 min。
(5)按下图安装转移槽进行转移过夜(0.4 M NaOH转移液)。
(6)转移完毕后取出尼龙膜,2xSSC浸泡5 min,滤纸吸干,夹在2层干净滤纸。
4. 预杂交与杂交
(1)预杂交:将尼龙膜置于预热DIG Easy Hyb工作液(37℃~42℃)中摇晃充分作用30 min。
(2)探针变性:DIG标记探针煮沸5 min 后迅速置于碎冰中,用预热DIG Easy Hyb工作液制备含探针的杂交液。
(3)弃去预杂交液,加入杂交液42℃摇动孵育4小时或过夜。
(4)2xSSC(in 0.%SDS)洗膜2次(5 minx2),不断摇动。
(5)5xSSC(in 0.%SDS)洗膜2次(155 minx2,65~68℃),期间不断摇动。
5. 杂交检测
(1)Washing buffer润洗1遍(3~5 min)。
(2)100 ml blocking buffer工作液封闭30 min。
(3)100 ml antibody buffer(1:5000)孵育30 min。
(4)Washing buffer洗膜(15 minx2)。
(5)20 ml detection buffer 平衡2~5 min。
(6)将尼龙膜置于10 ml color-substrate solution 棕色瓶中,避光数min至1天(出现颜色时不要摇动)。
(7)当出现条带时,TE-buffer洗膜(5 minx1),终止现色。
(8)照相记录,80℃烤干,储存。
(9)扫描计算EGFR基因扩增的倍数。
注意事项
1. 为了防止缓冲液流从凝胶边缘之外通过,沿凝胶的每一边放置一条 Parafilm膜,使滤纸桥与层叠上部的吸湿材料无法接触。
2. 核酸转移的选择尼龙膜比NC膜好,是目前较理想的核酸固相支持膜。
3. 尼龙膜漂洗尽量彻底,可降低背景。
4. color-substrate solution要新鲜配制。
常见问题
影响杂交的因素:
1.待检核酸分子的浓度和长度
(1)浓度越大,复性速度越快,敏感性越高;
(2)分子越大,转膜越困难,敏感性越低;
(3)转膜方法
2.探针的性质(标记效率、浓度,核酸性质)
(1)对于单链探针,浓度越高,杂交率增加;
(2)探针标记方法和检测方法的选择;
3.杂交液体积、温度和杂交时间
(1)体积越小,杂交动力学越高;
(2)DNA/DNA杂交适宜的复性温度为比Tm低20——25℃;
(3)温度越低,非特异性越高;温度越高,敏感性越低;
4.杂交液的离子强度
(1)低盐浓度时杂交率较低,随着盐浓度增加,杂交率增加(Na+的作用);
(2)高浓度的盐使碱基错配的杂交体更稳定,当进行序列不完全同源的杂交时,必须维持杂交液与洗膜液中较高的盐浓度;
5.非特异性杂交反应
杂交前封闭膜上非特异性杂交位点,减少其对探针的非特异吸附。
6.杂交后的漂洗
盐浓度、温度、次数、体积
7.固相膜的选择




