聚丙烯酰胺凝胶电泳纯化寡核苷酸实验
材料与仪器无菌的过滤水 乙腈 乙酸铵 正丁醇 不含指示染料的甲酰胺凝胶加样缓冲液 甲酰胺指示染料混合液 甲醇:水溶液 寡核苷酸洗脱缓冲液 TE 溶液 合成寡核苷
材料与仪器
无菌的过滤水 乙腈 乙酸铵 正丁醇 不含指示染料的甲酰胺凝胶加样缓冲液 甲酰胺指示染料混合液 甲醇:水溶液 寡核苷酸洗脱缓冲液 TE 溶液 合成寡核苷酸粗制品
MillexHV 滤器 石蜡封口膜或荧光薄层层析板 Sep-Pak 传统层析柱 注射器 紫外灯 水浴加热器
MillexHV 滤器 石蜡封口膜或荧光薄层层析板 Sep-Pak 传统层析柱 注射器 紫外灯 水浴加热器
步骤
材料
缓冲液和溶液
稀释缓存液至适当浓度。
建议使用无菌的过滤水(Milli-Q 或相当级)。
乙腈
毎个 Sep-PakC18 柱用 10 ml 高效液相(HPLC) 级乙腈。
乙酸铵(10mol/L)
每个 Sep-PakC18 柱用 2 ml 10 mmol/L 乙酸铵溶液。
正丁醇
不含指示染料的甲酰胺凝胶加样缓冲液
凝胶加样缓冲液含有未烯释的甲酰胺,不含指示染料 [溴酚兰和(或)二甲苯蓝]。凝胶加祥缓冲液中不加指示染料,染料或染料中的污染物可以与寡梭苷酸以相同的速率移动,而干扰通过紫外光吸收对样品的检测 (见步骤 14)。如需要,可在凝胶加样缓冲液中加 0.2% 的橙红 G, 该染料迁移至加样缓冲液的前沿,不会影响寡核苷黢的检测。
甲酰胺指示染料混合液
此溶液为甲酰胺与指示染料的水溶液(0.05% 二甲苯蓝和 0.05% 溴酚兰)的 50:50 混合液。可将其加到寡核苷酸样品相邻的加样孔作为分子质量标准。
甲醇:水溶液
将 6 ml 甲酵与 4 ml 过滤无菌水(Milli-Q 级)混合,每个 Sep-Pak C18 柱用 3 ml 甲醇:水溶液。
寡核苷酸洗脱缓冲液
0.5mol/L 乙酸铵
10 mmol/L 乙酸铁
有些研究者在寡核苷酸洗脱缓冲液中加入 0.1%(m/V)SDS。如杲用 Sep-Pak Cl8 柱层析纯化寡核苷酸、本方案不推荐使用 SDS(见步骤 16 的注解)。
TE 溶液(pH8.0)
核酸与寡核苷酸
合成寡核苷酸粗制品
合成寡核苷酸通常由厂商提供,为已除去合成反应的保护基的冻干品(见信息栏「寡核苷酸合成」)。
脱保护一般包括将制品在 NH4OH 浓溶液中 55°C 下保温约 5 h。[一些新的 DNA 合成方案对一种或几种核苷使用不同的保护基(如乙酰化保护的 dC), 能在 10min 内除去]。
寡孩苷酸纯化前,应确定已经过脱保护反应。如提供的寡核背酸是在 NH4OH 中,可将 0.5~1.0 ml 液体转移到 1.5 ml 微量离心管,用离心干燥机(SavantSpeed Vac 或类似产品)室温挥发干燥。
当第一次打开一个粗制寡核苷酸时,应缓慢打开管盖,让氨气挥发(放在化学通风柜中更好),这样可减少寡核苷酸喷酒到房间周围的机会。
专用设备
MillexHV 滤器(Millipore,0.45nm 孔径)
石蜡封口膜或荧光薄层层析板
层析板可从美国 Erinkmann 公司或欧洲 E.Merck 公司购买、如 Merck 硅胶 20 cmX20 cm 板。
Sep-Pak 传统层析柱,短柱身
Sep-Pak 传统层析柱(可从 Millipore 公司的 Waters 部门购买)含有 360 mg/柱的疏水(C18) 反相层析树脂。纯化是利用核苷酸在极性较髙的溶剂(水溶液)中与树脂结合,而当溶剂(如甲醇与水混合液)的极性降低时洗脱的原理。窠丙烯酰胺凝胶中每 10OD160 寡核苷酸需一个层析柱。
注射器(5 ml 和 10 ml, 聚丙稀)
每个寡核苷酸样品需一个 5 ml 和一个 10 ml 注射器。
紫外灯(260nm, 手提式)
水浴或预设 55°C 加热器
附加试剂
步骤 7~9 所需试剂列于第 12章方案 8 和 11。
方法
寡核苷酸粗样品的凝胶电泳准备
1. 无菌微量离心管中,用无菌过滤水(Milli-Q 或相当级)配成 10umol/L 的粗寡核苷酸溶液,充分震荡。
由于寡核苷酸合成中产生的不溶性苯并蒽,溶液常出现轻度棍浊。
2. 室溫下以微量离心机的最大离心转速离心 5 min, 将上清移入新的无菌微量离心管。
3. 用 400ul 正丁醇(见附录 8) 抽提溶液三次,去除上层有机相。
如果时间短,可省去异丁醇抽提,不会引起问题。此时,室温下以最大离心转速离心 5 min, 将上淸移入新的无菌微量离心管。将 10~30ul 原溶液加入变性聚丙烯酰胺凝胶的 6 个加样槽(lcm), 见本章末的描述。
4. 室温下用离心干燥机(Savant Speed Vac 或类似产品)将溶液干燥。离心管中应含有浅黄色沉淀物和乳白色粉末。
5. 用 200ul 无菌过滤水(Milli-Q 或相当级)溶解沉淀物和粉末。
6. 用下列方法估计样品中寡核苷酸的量:将 1ul 溶液加到 1ml 水中,充分混合后测 OD260, 计算寡核苷酸浓度。
寡核苷酸量常以单位表示。1OD 相当于在 1 cm 光径的比色杯中 1ml 溶液中的寡核苷酸量产生的光密度计算寡核苷酸亳摩尔消光系数(e)的公式如下:
e=A(15.2)+G(12.01)+C(7.05)+T(8.4)
式中 A、G、C、T 为寡核苷黢序列中各种核苷酸的倍数,括号中的数值为 pH8.0 时每种脱氧核苷酸的摩尔消光系数。例如,一个含 5 个 dA、4 个 dG、4 个 dC 和 6 个 dT 残基的 19 聚体寡核苷酸的毫摩尔消光系数为
(5X15.2)+(4X12.01)+(4X7.05)+(6X8.4)=202.64 mmol/(L·cm)
按以下公式计算未稀释的寡核苷酸液浓度(C):
C=(OD260)(1000)/s
凝胶电泳纯化合成的寡核苷酸
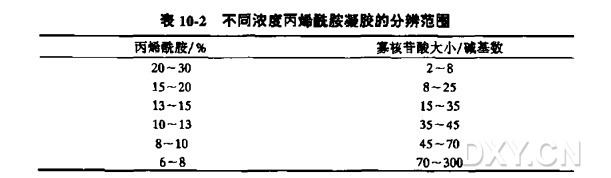
7. 制备适当浓度(表 10-2) 的变性聚丙烯酰胺凝胶(第 12 章方案 8),胶的加样槽长度应在 1 cm 左右。
8. 用恒功率(50~70W)预电泳约 45 min 或凝胶温度达 45~50°C。关电源后去掉电极插头线。
預电泳可以使胶孔中的过硫酸铵移出,更重要的是让凝胶升温至 DNA 电泳的理想温度。
9. 不要停顿,在一个或多个加样槽内按下列方法加入约 2OD260 的寡核苷酸(为获得最高分辨率,溶液体积应为 10ul 或<10ul):
a. 在寡核苷酸溶液中加入等体积的无染料甲酰胺加样缓冲液,充分震荡混匀,55°C 下加热 5 min 以消除二级结构。
b. 用 1XTBE 将加样孔中的尿素冲掉。
c. 将加热过的寡核苷酸加入加样孔。取 5ul 含染料的甲酰胺上样液加入一个未使用的加样孔中。
有关聚丙烯酰胺凝胶加样的详细内容,参见 12 章,方案 11。
10. 在 1500V 电压下电泳,直至寡核苷酸移至凝胶的近 2/3 处。
可根据染料位置估计寡核苷酸的位置,详见表 10-3。应注意,带有 5'末端羟基的合成寡核苷酸在变性聚丙烯酰胺凝胶的移动速率比相同长度的磷酸化寡核苷酸要慢。而且,由于未知的原因,寡核苷酸泳动的速率取决于其碱基组成及序列。因此,聚丙烯酰胺凝胶中,寡核苷酸的预期位置与观察到的位置之间没有精确的对应关系。

11. 将凝胶模板平铺在底部为塑料防护的试验台垫纸上,将带槽口的小块板向上。在进行下一步前,先将凝胶冷却至 37°C 以下。
12. 去除多余的胶带,用边条或凝胶分离工具缓慢、小心地撬开凝胶模板,此时凝胶应黏着在较长的(未硅烷化)玻璃板上。
警惕戴好防护限镣,进行此步骤时玻璃板可能会破碎。
如果凝胶黏附于两块破璃板上. 先将板放回原处,使较小的或带槽的玻璃板背向凝胶,反转玻璃板再试。
13. 将一张 Sarari 膜放在凝胶上,反转玻璃板,这样凝胶便转贴到 Saraii 膜上。在预计寡核苷酸所在位置的凝胶下方,放一张石蜡封口膜或荧光薄层层析板。
14. 用手提式紫外灯在 260nm 波長从上方照射凝胶。
凝胶内的 DNA 吸收紫外光,在石蜡膜或荧光薄层层析板的荧光背聚下,DNA 呈现深蓝色条带。如果 DNA 条带难以辨认,可以在暗室里用手提式紫外灯观察。
15. 待回收的目标寡核苷酸应是迁移最慢的条带(最靠近胶的顶端),用锋利、清洁的手术刀或剃须刀切下每一条目的 DNA 条带,并注意不要取小于目的寡核苷酸的紫外吸收物。
有关切取目的 DNA 带的其他内容,参见本方案末信息栏“聚丙烯酰胺凝胶中寡核苷酸的观察”。
16. 将凝胶切片移入 3~4 个微量离心管中,在每一管中加入 1 ml 寡核苷酸洗脱缓冲液, 用一次性移液器吸头在管中转动并压向管壁,将凝胶挤碎。封好管口,在摇动培养箱内 37°C 溫育 12 h。
含有SDS洗脱缓冲液在处理Sep-Pak层析第2、3组分干燥后,有时会产生乳白色沉淀,这些沉淀物很可能是结合于柱上的SDS, 当用甲醇-水洗脱时,在寡核苷酸稍后洗脱下来。只要SDS不与寡核苷酸共同存在(第一组分),去污剂就不会引起问题,并可能改善回收率。但是,即使最后的寡核苷酸中有很少量的SDS,它也能抑制随后的酶促反应(如磷酸化及引物延伸),这也是本洗脱液含SDS的原因。
17. 室温下以微量离心机的最大离心转速离心5 min, 收集上清,转移到5 ml—次性注射器中,用Millex HV滤器过滤,收集过滤液于15 ml聚丙烯管中。
用Sep-Pak C18层析柱分离合成的寡核苷酸
18. 按下列步骤准备Sep-Pak C18反相层析柱:
a. 将10 ml—次性注射器针筒连接于Sep-Pak C18传统层析柱的长端。
b. 在注射器针筒中加入10 ml乙腈,用柱芯缓慢推压乙腈使其通过层析柱。
c. 取下注射器,将注射器柱芯拔出,这样可以防止空气抽入层析柱内。重新将注射器针筒连于层析柱。
d. 在针筒内加入10 ml过滤无菌水(Milli-Q级或相当级),用注射器柱芯缓慢推压,使水通过层析柱。重复步骤c。
e. 将2 ml10 mml/L乙酸铵缓慢推出层析柱,取下注射器,移去注射器柱芯,将注射器针筒重新连于层析柱。此时层析柱已可使用。
19. 将凝胶纯化寡核苷酸溶液加入注射器针筒中(步骤17),推动注射器柱芯使其缓慢通过层析柱,用无菌的50 ml聚乙烯离心管收集洗脱液。重复步骤18c。
20. 用注射器缓慢将10 ml 水推入层析柱,重复冲洗二次以上。
21. 用lml甲醇-水溶液将结合于Sep-Pak C18层析柱上的寡核苷酸洗脱下来,共三次,每次洗脱后重复步骤18c。分别收集各次洗脱液,用甲醇-水溶液为空白,分别测定三只管内溶液的 OD260光吸收值。>90% 的寡核苷酸应存在于第一组分。
22. 用离心干燥机使含寡核苷酸的溶液挥发干燥。
23. 将寡核苷酸溶于总体积为 200ul 的水或 TE(pH8.0) 中。
24. 吸取 5ul 溶液加到含有 995ul水的比色杯中,混匀后,测定洗脱样品的OD260 值,按本方案步骤 6 所述计算洛液中寡核苷酸总量(步骤 23)。


缓冲液和溶液
稀释缓存液至适当浓度。
建议使用无菌的过滤水(Milli-Q 或相当级)。
乙腈
毎个 Sep-PakC18 柱用 10 ml 高效液相(HPLC) 级乙腈。
乙酸铵(10mol/L)
每个 Sep-PakC18 柱用 2 ml 10 mmol/L 乙酸铵溶液。
正丁醇
不含指示染料的甲酰胺凝胶加样缓冲液
凝胶加样缓冲液含有未烯释的甲酰胺,不含指示染料 [溴酚兰和(或)二甲苯蓝]。凝胶加祥缓冲液中不加指示染料,染料或染料中的污染物可以与寡梭苷酸以相同的速率移动,而干扰通过紫外光吸收对样品的检测 (见步骤 14)。如需要,可在凝胶加样缓冲液中加 0.2% 的橙红 G, 该染料迁移至加样缓冲液的前沿,不会影响寡核苷黢的检测。
甲酰胺指示染料混合液
此溶液为甲酰胺与指示染料的水溶液(0.05% 二甲苯蓝和 0.05% 溴酚兰)的 50:50 混合液。可将其加到寡核苷酸样品相邻的加样孔作为分子质量标准。
甲醇:水溶液
将 6 ml 甲酵与 4 ml 过滤无菌水(Milli-Q 级)混合,每个 Sep-Pak C18 柱用 3 ml 甲醇:水溶液。
寡核苷酸洗脱缓冲液
0.5mol/L 乙酸铵
10 mmol/L 乙酸铁
有些研究者在寡核苷酸洗脱缓冲液中加入 0.1%(m/V)SDS。如杲用 Sep-Pak Cl8 柱层析纯化寡核苷酸、本方案不推荐使用 SDS(见步骤 16 的注解)。
TE 溶液(pH8.0)
核酸与寡核苷酸
合成寡核苷酸粗制品
合成寡核苷酸通常由厂商提供,为已除去合成反应的保护基的冻干品(见信息栏「寡核苷酸合成」)。
脱保护一般包括将制品在 NH4OH 浓溶液中 55°C 下保温约 5 h。[一些新的 DNA 合成方案对一种或几种核苷使用不同的保护基(如乙酰化保护的 dC), 能在 10min 内除去]。
寡孩苷酸纯化前,应确定已经过脱保护反应。如提供的寡核背酸是在 NH4OH 中,可将 0.5~1.0 ml 液体转移到 1.5 ml 微量离心管,用离心干燥机(SavantSpeed Vac 或类似产品)室温挥发干燥。
当第一次打开一个粗制寡核苷酸时,应缓慢打开管盖,让氨气挥发(放在化学通风柜中更好),这样可减少寡核苷酸喷酒到房间周围的机会。
专用设备
MillexHV 滤器(Millipore,0.45nm 孔径)
石蜡封口膜或荧光薄层层析板
层析板可从美国 Erinkmann 公司或欧洲 E.Merck 公司购买、如 Merck 硅胶 20 cmX20 cm 板。
Sep-Pak 传统层析柱,短柱身
Sep-Pak 传统层析柱(可从 Millipore 公司的 Waters 部门购买)含有 360 mg/柱的疏水(C18) 反相层析树脂。纯化是利用核苷酸在极性较髙的溶剂(水溶液)中与树脂结合,而当溶剂(如甲醇与水混合液)的极性降低时洗脱的原理。窠丙烯酰胺凝胶中每 10OD160 寡核苷酸需一个层析柱。
注射器(5 ml 和 10 ml, 聚丙稀)
每个寡核苷酸样品需一个 5 ml 和一个 10 ml 注射器。
紫外灯(260nm, 手提式)
水浴或预设 55°C 加热器
附加试剂
步骤 7~9 所需试剂列于第 12章方案 8 和 11。
方法
寡核苷酸粗样品的凝胶电泳准备
1. 无菌微量离心管中,用无菌过滤水(Milli-Q 或相当级)配成 10umol/L 的粗寡核苷酸溶液,充分震荡。
由于寡核苷酸合成中产生的不溶性苯并蒽,溶液常出现轻度棍浊。
2. 室溫下以微量离心机的最大离心转速离心 5 min, 将上清移入新的无菌微量离心管。
3. 用 400ul 正丁醇(见附录 8) 抽提溶液三次,去除上层有机相。
如果时间短,可省去异丁醇抽提,不会引起问题。此时,室温下以最大离心转速离心 5 min, 将上淸移入新的无菌微量离心管。将 10~30ul 原溶液加入变性聚丙烯酰胺凝胶的 6 个加样槽(lcm), 见本章末的描述。
4. 室温下用离心干燥机(Savant Speed Vac 或类似产品)将溶液干燥。离心管中应含有浅黄色沉淀物和乳白色粉末。
5. 用 200ul 无菌过滤水(Milli-Q 或相当级)溶解沉淀物和粉末。
6. 用下列方法估计样品中寡核苷酸的量:将 1ul 溶液加到 1ml 水中,充分混合后测 OD260, 计算寡核苷酸浓度。
寡核苷酸量常以单位表示。1OD 相当于在 1 cm 光径的比色杯中 1ml 溶液中的寡核苷酸量产生的光密度计算寡核苷酸亳摩尔消光系数(e)的公式如下:
e=A(15.2)+G(12.01)+C(7.05)+T(8.4)
式中 A、G、C、T 为寡核苷黢序列中各种核苷酸的倍数,括号中的数值为 pH8.0 时每种脱氧核苷酸的摩尔消光系数。例如,一个含 5 个 dA、4 个 dG、4 个 dC 和 6 个 dT 残基的 19 聚体寡核苷酸的毫摩尔消光系数为
(5X15.2)+(4X12.01)+(4X7.05)+(6X8.4)=202.64 mmol/(L·cm)
按以下公式计算未稀释的寡核苷酸液浓度(C):
C=(OD260)(1000)/s
凝胶电泳纯化合成的寡核苷酸
7. 制备适当浓度(表 10-2) 的变性聚丙烯酰胺凝胶(第 12 章方案 8),胶的加样槽长度应在 1 cm 左右。

8. 用恒功率(50~70W)预电泳约 45 min 或凝胶温度达 45~50°C。关电源后去掉电极插头线。
預电泳可以使胶孔中的过硫酸铵移出,更重要的是让凝胶升温至 DNA 电泳的理想温度。
9. 不要停顿,在一个或多个加样槽内按下列方法加入约 2OD260 的寡核苷酸(为获得最高分辨率,溶液体积应为 10ul 或<10ul):
a. 在寡核苷酸溶液中加入等体积的无染料甲酰胺加样缓冲液,充分震荡混匀,55°C 下加热 5 min 以消除二级结构。
b. 用 1XTBE 将加样孔中的尿素冲掉。
c. 将加热过的寡核苷酸加入加样孔。取 5ul 含染料的甲酰胺上样液加入一个未使用的加样孔中。
有关聚丙烯酰胺凝胶加样的详细内容,参见 12 章,方案 11。
10. 在 1500V 电压下电泳,直至寡核苷酸移至凝胶的近 2/3 处。
可根据染料位置估计寡核苷酸的位置,详见表 10-3。应注意,带有 5'末端羟基的合成寡核苷酸在变性聚丙烯酰胺凝胶的移动速率比相同长度的磷酸化寡核苷酸要慢。而且,由于未知的原因,寡核苷酸泳动的速率取决于其碱基组成及序列。因此,聚丙烯酰胺凝胶中,寡核苷酸的预期位置与观察到的位置之间没有精确的对应关系。

11. 将凝胶模板平铺在底部为塑料防护的试验台垫纸上,将带槽口的小块板向上。在进行下一步前,先将凝胶冷却至 37°C 以下。
12. 去除多余的胶带,用边条或凝胶分离工具缓慢、小心地撬开凝胶模板,此时凝胶应黏着在较长的(未硅烷化)玻璃板上。
警惕戴好防护限镣,进行此步骤时玻璃板可能会破碎。
如果凝胶黏附于两块破璃板上. 先将板放回原处,使较小的或带槽的玻璃板背向凝胶,反转玻璃板再试。
13. 将一张 Sarari 膜放在凝胶上,反转玻璃板,这样凝胶便转贴到 Saraii 膜上。在预计寡核苷酸所在位置的凝胶下方,放一张石蜡封口膜或荧光薄层层析板。
14. 用手提式紫外灯在 260nm 波長从上方照射凝胶。
凝胶内的 DNA 吸收紫外光,在石蜡膜或荧光薄层层析板的荧光背聚下,DNA 呈现深蓝色条带。如果 DNA 条带难以辨认,可以在暗室里用手提式紫外灯观察。
15. 待回收的目标寡核苷酸应是迁移最慢的条带(最靠近胶的顶端),用锋利、清洁的手术刀或剃须刀切下每一条目的 DNA 条带,并注意不要取小于目的寡核苷酸的紫外吸收物。
有关切取目的 DNA 带的其他内容,参见本方案末信息栏“聚丙烯酰胺凝胶中寡核苷酸的观察”。
16. 将凝胶切片移入 3~4 个微量离心管中,在每一管中加入 1 ml 寡核苷酸洗脱缓冲液, 用一次性移液器吸头在管中转动并压向管壁,将凝胶挤碎。封好管口,在摇动培养箱内 37°C 溫育 12 h。
含有SDS洗脱缓冲液在处理Sep-Pak层析第2、3组分干燥后,有时会产生乳白色沉淀,这些沉淀物很可能是结合于柱上的SDS, 当用甲醇-水洗脱时,在寡核苷酸稍后洗脱下来。只要SDS不与寡核苷酸共同存在(第一组分),去污剂就不会引起问题,并可能改善回收率。但是,即使最后的寡核苷酸中有很少量的SDS,它也能抑制随后的酶促反应(如磷酸化及引物延伸),这也是本洗脱液含SDS的原因。
17. 室温下以微量离心机的最大离心转速离心5 min, 收集上清,转移到5 ml—次性注射器中,用Millex HV滤器过滤,收集过滤液于15 ml聚丙烯管中。
用Sep-Pak C18层析柱分离合成的寡核苷酸
18. 按下列步骤准备Sep-Pak C18反相层析柱:
a. 将10 ml—次性注射器针筒连接于Sep-Pak C18传统层析柱的长端。
b. 在注射器针筒中加入10 ml乙腈,用柱芯缓慢推压乙腈使其通过层析柱。
c. 取下注射器,将注射器柱芯拔出,这样可以防止空气抽入层析柱内。重新将注射器针筒连于层析柱。
d. 在针筒内加入10 ml过滤无菌水(Milli-Q级或相当级),用注射器柱芯缓慢推压,使水通过层析柱。重复步骤c。
e. 将2 ml10 mml/L乙酸铵缓慢推出层析柱,取下注射器,移去注射器柱芯,将注射器针筒重新连于层析柱。此时层析柱已可使用。
19. 将凝胶纯化寡核苷酸溶液加入注射器针筒中(步骤17),推动注射器柱芯使其缓慢通过层析柱,用无菌的50 ml聚乙烯离心管收集洗脱液。重复步骤18c。
20. 用注射器缓慢将10 ml 水推入层析柱,重复冲洗二次以上。
21. 用lml甲醇-水溶液将结合于Sep-Pak C18层析柱上的寡核苷酸洗脱下来,共三次,每次洗脱后重复步骤18c。分别收集各次洗脱液,用甲醇-水溶液为空白,分别测定三只管内溶液的 OD260光吸收值。>90% 的寡核苷酸应存在于第一组分。
22. 用离心干燥机使含寡核苷酸的溶液挥发干燥。
23. 将寡核苷酸溶于总体积为 200ul 的水或 TE(pH8.0) 中。
24. 吸取 5ul 溶液加到含有 995ul水的比色杯中,混匀后,测定洗脱样品的OD260 值,按本方案步骤 6 所述计算洛液中寡核苷酸总量(步骤 23)。







