用S1核酸酶对RNA作图
原理三种不同的核酸酶——S1 核酸酶、RNA 酶、外切核酸酶Ⅶ被用来进行 RNA 定量,确定内含子位置,以及用来鉴定在克隆的 DNA 模板上的 mRNA 的 5
原理
三种不同的核酸酶——S1 核酸酶、RNA 酶、外切核酸酶Ⅶ被用来进行 RNA 定量,确定内含子位置,以及用来鉴定在克隆的 DNA 模板上的 mRNA 的 5' 端和 3' 端的位置。当检测 RNA 被杂交到 DNA 模板上时,用核酸酶 S1 进行保护试验的分析;当检测 RNA 被杂交到来自 DNA 模板的 RNA 上时用 RNA 酶。
材料与仪器
T4 噬菌体多聚核苷酸激酶 大肠杆菌 DNA 聚合酶的 Klenow 片段 S1 核酸酶 S1 核酸酶消化缓冲液 限制性核酸内切酶 载体 RNA 标准 RNA 单链 RNA DNA 探针
过硫酸铵 复性缓冲液 乙醇 凝胶洗脱缓冲液 RNA 杂交缓冲液 S1 核酸酶终止缓冲液 苯酚 氯仿 RNA 加样缓冲液 乙酸钠 TE 四甲基乙二胺 三氯乙酸
变性聚丙烯酰胺凝胶 水浴 Whatman 3 MM 滤纸
过硫酸铵 复性缓冲液 乙醇 凝胶洗脱缓冲液 RNA 杂交缓冲液 S1 核酸酶终止缓冲液 苯酚 氯仿 RNA 加样缓冲液 乙酸钠 TE 四甲基乙二胺 三氯乙酸
变性聚丙烯酰胺凝胶 水浴 Whatman 3 MM 滤纸
步骤
一、材料
1. 缓冲液和溶液
过硫酸铵(10%)
10X 复性缓冲液(100 mmol/L Tris-Cl (pH 7.5),100 mmol/L MgCl2,0.5 mol/L NaCl,100 mmol/L 二硫苏糖醇(DTT))
乙醇
凝胶洗脱缓冲液(0.5 mol/L 乙酸铵,1 mmol/L EDTA ( pH 8.0),0.1% (m/V) SDS)
RNA 杂交缓冲液
S1 核酸酶终止缓冲液(4 mol/L 乙酸铵,50 mmol/L EDTA(pH 8.0),50 ug/ml 载体 RNA)
苯酚:氯仿(1:1,V/V)
RNA 加样缓冲液
乙酸钠(3 mol/L,pH 5.2)
TE ( pH 7.6)
四甲基乙二胺(TEMED)
三氯乙酸(TCA)(1% 和 10%)
2. 酶和缓冲液
T4 噬菌体多聚核苷酸激酶
大肠杆菌 DNA 聚合酶的 Klenow 片段(10 单位/μl)
S1 核酸酶(与 S1 核酸酶消化缓冲液一起使用)
S1 核酸酶消化缓冲液(0.28 mol/L NaCl,0.05 mol/L 乙酸钠(pH 4.5),4.5 mmol/L ZnSO4·7H2O)
限制性核酸内切酶
3. 凝胶
含 8 mol/L 尿素的变性聚丙烯酰胺凝胶
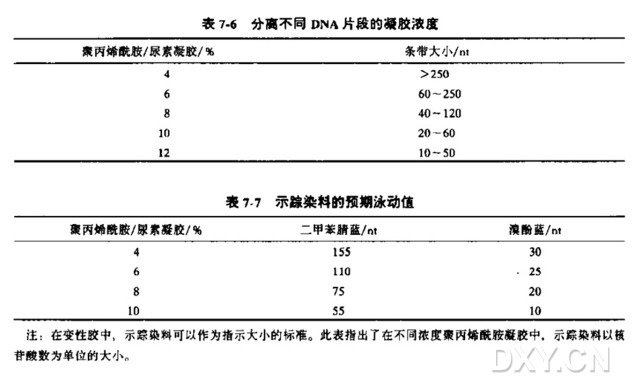
4. 核酸和寡核苷酸
载体 RNA ( 酵母 tRNA)
含有四种 dNTP 的溶液(20 mmol/L)(用 25 mmol/L Tris-Cl ( pH 8.0) 溶解 dNTP,分装成小份储于 -20℃。)
标准 RNA
溶于蒸馏水中的合成寡核苷酸(10 pmol/μl )
模板 DNA ( 1 μg/μl),单链
单链 RNA
5. 探针
均匀标记且是单链的 DNA 探针
6. 放射性化合物
[γ-32P] ATP(10 mCi/ml,3000 Ci/mmol)
7. 专用装备
水浴,分别预设为 65℃,85℃,95℃,以得到适合的消化温度以及理想的杂交温度。
Whatman 3 MM 滤纸(或相当材料)

二、方法
随机标记的单链 DNA 探针的制备
1. 制备含 8 mol/L 尿素的聚丙烯酰胺微型凝胶(13 cm X 15 cm X 0.75 cm ) ( 例如 Bio-Rad Mini-Protean)
(1) 混匀下列试剂
7.2 g 尿素
1.5 ml 10X TBE
加入适当量的 40% 丙烯酰胺(丙烯酰胺:甲叉丙烯酰胺 19:1)制备含有所需浓度的聚丙烯酰胺凝胶。
(2) 加水到终体积 15 ml
(3) 室温下在磁力搅拌器上搅拌直至尿素溶解。再加入:
120 μl 10% 过硫酸铵
16 μl TEMED
快速混匀溶液并将胶倒入微型胶的模子。
2. 在胶凝结的过程中,混合下列试剂:
10 pmol ( 1 μl)未标记的寡核苷酸
10 μl [γ-32P] ATP(10 mCi/ml,3000 Ci/mmol)
2 μl 10X 多核苷酸激酶缓冲液
6 μl H2O
10 单位(1 μl)多核苷酸激酶
将反应混合物 37℃ 温育 45 min,再 95℃ 温育 3 min 灭活多核苷酸激酶。
3. 向激酶反应中加入:
2 μl(2 μg)单链 DNA 模板
4 μl 10X 复性缓冲液
14 μl H2O
将反应混合物 65℃ 温育 10 min,再冷却到室温。
4. 向第 3 步的反应混合物加入:
4 μl dNTP 混合物
1 μl (10 单位)大肠杆菌 DNA 聚合酶Ⅰ的 Klenow 片段
将反应混合物室温温育 15 min,再 65℃ 温育 3 min 灭活 DNA 聚合酶。
5. 调整反应混合物的离子组成和 pH 值以适应限制性酶。加入 20 单位限制性酶,于适当温度消化 2 h。
6. 向限制性核酸内切酶消化反应中加入:
2 μl 载体 RNA
5 μl 3 mol/L 醋酸钠(pH 5.2)
用标准的乙醇沉淀法回收 DNA 探针。
7. 用 20 μl 凝胶上样缓冲液溶解 DNA,95℃ 温育 5 min 使之变性,然后快速冷却到 0℃。
用凝胶电泳纯化探针
8. 当 DNA 在 95℃ 温育时,清洗凝胶的加样孔除去尿素,立刻加入探针。
9. 电泳直至溴酚蓝到达凝胶的底部(200 mA 约 30 min)。
10. 除去灌胶装置,让胶贴附在底层玻璃板上。用塑料膜(例如 Saran 膜)包裹凝胶和玻璃板。确保胶和塑料膜间没有气泡。
注意:撬开玻璃片时,戴上保护眼睛的装置。
11. 让凝胶在 X 线片上曝光。在胶片上作出玻板角和边的永久的记号。同时作出溴酚蓝和二甲苯腈蓝位置的记号。
通常 2~10 min 的曝光足够得到放射标记探针的图像。
12. 分开玻璃板和胶片,用手术刀除去放射标记的条带。将切过的胶在一张新的胶片上曝光,以保证含有正确分子大小条带的凝胶区域确实被切下来。
13. 将切下的凝胶片段转入灭菌的微离心管中,加入恰好足够体积的凝胶洗脱缓冲液盖住凝胶(250~500 μl)。将盖上的离心管在摇床上室温过夜。
14. 最大转速离心 5 min。
15. 用自动的吸量装置将上清转入新的离心管中,注意不要吸入聚丙烯酰胺。标记的探针用液闪分光镜检测应为大约 10000 cpm/μl。
16. -70℃ 保存探针。

待测 RNA 和放射标记的 DNA 探针间的杂交
17. 将 0.5~150 μg 的 RNA ( 待测的和标准的)平均分入每一个灭菌的微型离心管中。向每一个管中加入过量的均匀标记的单链 DNA 探针。
18. 加入 10% 体积的 3 mol/L 醋酸钠(pH 5.2),2.5 倍体积的冰冷的乙醇,沉淀 RNA 和 DNA。0℃ 放置 30 min,最大转速 4℃ 离心 15 min 回收核酸。去除乙醇的上清,用 70% 的乙醇洗涤,再次离心。小心的除去所有的乙醇,将含有 RNA 和 DNA 的沉淀室温放置直至乙醇的残迹蒸发。

19. 用 30 μl 杂交缓冲液溶解核酸沉淀。吹吸几次以保证沉淀彻底溶解。
20. 将离心管的盖盖紧,将杂交反应在 85℃ 水浴温育 10 min 使核酸变性。
21. 快速将离心管转移到调至杂交温度(通常 65℃)的水浴中。转移过程中,不要让离心管冷却到低于杂交的温度。在选定的温度下,将 DNA 和 RNA 杂交 12~16 h。
S1 核酸酶消化 DNA-RNA 杂合体
22. 注意保持离心管浸没在水中,打开管盖。快速加入 300 μl 冰冷的 S1 核酸酶消化缓冲液,并立即将离心管从水浴中拿出。温和振荡以混匀离心管中物质,再将离心管转移到调至 S1 核酸酶消化温度的水浴中。根据所需要的消化程度,温育 1~2 h。

23. 将反应体系冷至 0℃。加入 80 μl S1 核酸酶终止缓冲液并振荡混匀溶液。
24. 用苯酚:氯仿萃取反应体系一次。反应体系在微型离心管中以最大转速室温离心 2 min,将上淸转到另一个离心管中。加入两倍体积的乙醇,混匀,-20℃ 放置 1 h。
25. 以最大转速 4℃ 离心 15 min 回收核酸。小心的除去所有的上清,将打开的离心管在室温放置直到可见的乙醇残迹蒸发掉。
用凝胶电泳分析 S1 核酸酶产物
26. 用 4 μl TE 缓冲液(pH 7.6) 溶解核酸沉淀。加入 6 μl 上样缓冲液并混匀。
27. 95℃ 温育核酸 5 min,立即转移到冰上。稍微离心使样品聚集在离心管的底部。
28. 用聚丙烯酰胺 8 mol/L 尿素的凝胶电泳检验放射标记的 DNA。
29. 当示踪染料在胶上移动了适当的距离后,关掉电源拆卸电泳装置。轻轻的橇开大玻璃板的一角并将大玻璃板从胶上移开。为确定方向,切下胶的一角。
30. 将含有胶的玻璃板转移到含过量的 10% 三氯乙酸的托盘中。室温下轻微晃动托盘 10 min。
31. 将 10% 的三氯乙酸溶液倒掉,换过量的 1% 三氯乙酸。室温摇动 5 min。
32. 倒掉 1% 的三氯乙酸溶液,用去离子水轻微的漂洗一下已被固定的胶。将玻璃板和胶一起拿出托盘,放在平的地方。用纸巾除去多余的水。
33. 剪下每一边都比胶长 1 cm 的 Whatman 3 MM 滤纸(或相同材料)。将纸置于胶的上面再将玻璃板颠倒过来从而把胶转移到滤纸上。
34. 移去玻璃板,把胶放在凝胶干燥器中 60℃ 干燥 1~1.5 h。
35. 获得干胶的放射自显影图。用光密度测定法或磷光成像法扫描图像,或者切下含有片段的凝胶用液闪分光光度计计量。
1. 缓冲液和溶液
过硫酸铵(10%)
10X 复性缓冲液(100 mmol/L Tris-Cl (pH 7.5),100 mmol/L MgCl2,0.5 mol/L NaCl,100 mmol/L 二硫苏糖醇(DTT))
乙醇
凝胶洗脱缓冲液(0.5 mol/L 乙酸铵,1 mmol/L EDTA ( pH 8.0),0.1% (m/V) SDS)
RNA 杂交缓冲液
S1 核酸酶终止缓冲液(4 mol/L 乙酸铵,50 mmol/L EDTA(pH 8.0),50 ug/ml 载体 RNA)
苯酚:氯仿(1:1,V/V)
RNA 加样缓冲液
乙酸钠(3 mol/L,pH 5.2)
TE ( pH 7.6)
四甲基乙二胺(TEMED)
三氯乙酸(TCA)(1% 和 10%)
2. 酶和缓冲液
T4 噬菌体多聚核苷酸激酶
大肠杆菌 DNA 聚合酶的 Klenow 片段(10 单位/μl)
S1 核酸酶(与 S1 核酸酶消化缓冲液一起使用)
S1 核酸酶消化缓冲液(0.28 mol/L NaCl,0.05 mol/L 乙酸钠(pH 4.5),4.5 mmol/L ZnSO4·7H2O)
限制性核酸内切酶
3. 凝胶
含 8 mol/L 尿素的变性聚丙烯酰胺凝胶

4. 核酸和寡核苷酸
载体 RNA ( 酵母 tRNA)
含有四种 dNTP 的溶液(20 mmol/L)(用 25 mmol/L Tris-Cl ( pH 8.0) 溶解 dNTP,分装成小份储于 -20℃。)
标准 RNA
溶于蒸馏水中的合成寡核苷酸(10 pmol/μl )
模板 DNA ( 1 μg/μl),单链
单链 RNA
5. 探针
均匀标记且是单链的 DNA 探针
6. 放射性化合物
[γ-32P] ATP(10 mCi/ml,3000 Ci/mmol)
7. 专用装备
水浴,分别预设为 65℃,85℃,95℃,以得到适合的消化温度以及理想的杂交温度。
Whatman 3 MM 滤纸(或相当材料)

二、方法
随机标记的单链 DNA 探针的制备
1. 制备含 8 mol/L 尿素的聚丙烯酰胺微型凝胶(13 cm X 15 cm X 0.75 cm ) ( 例如 Bio-Rad Mini-Protean)
(1) 混匀下列试剂
7.2 g 尿素
1.5 ml 10X TBE
加入适当量的 40% 丙烯酰胺(丙烯酰胺:甲叉丙烯酰胺 19:1)制备含有所需浓度的聚丙烯酰胺凝胶。
(2) 加水到终体积 15 ml
(3) 室温下在磁力搅拌器上搅拌直至尿素溶解。再加入:
120 μl 10% 过硫酸铵
16 μl TEMED
快速混匀溶液并将胶倒入微型胶的模子。
2. 在胶凝结的过程中,混合下列试剂:
10 pmol ( 1 μl)未标记的寡核苷酸
10 μl [γ-32P] ATP(10 mCi/ml,3000 Ci/mmol)
2 μl 10X 多核苷酸激酶缓冲液
6 μl H2O
10 单位(1 μl)多核苷酸激酶
将反应混合物 37℃ 温育 45 min,再 95℃ 温育 3 min 灭活多核苷酸激酶。
3. 向激酶反应中加入:
2 μl(2 μg)单链 DNA 模板
4 μl 10X 复性缓冲液
14 μl H2O
将反应混合物 65℃ 温育 10 min,再冷却到室温。
4. 向第 3 步的反应混合物加入:
4 μl dNTP 混合物
1 μl (10 单位)大肠杆菌 DNA 聚合酶Ⅰ的 Klenow 片段
将反应混合物室温温育 15 min,再 65℃ 温育 3 min 灭活 DNA 聚合酶。
5. 调整反应混合物的离子组成和 pH 值以适应限制性酶。加入 20 单位限制性酶,于适当温度消化 2 h。
6. 向限制性核酸内切酶消化反应中加入:
2 μl 载体 RNA
5 μl 3 mol/L 醋酸钠(pH 5.2)
用标准的乙醇沉淀法回收 DNA 探针。
7. 用 20 μl 凝胶上样缓冲液溶解 DNA,95℃ 温育 5 min 使之变性,然后快速冷却到 0℃。
用凝胶电泳纯化探针
8. 当 DNA 在 95℃ 温育时,清洗凝胶的加样孔除去尿素,立刻加入探针。
9. 电泳直至溴酚蓝到达凝胶的底部(200 mA 约 30 min)。
10. 除去灌胶装置,让胶贴附在底层玻璃板上。用塑料膜(例如 Saran 膜)包裹凝胶和玻璃板。确保胶和塑料膜间没有气泡。
注意:撬开玻璃片时,戴上保护眼睛的装置。
11. 让凝胶在 X 线片上曝光。在胶片上作出玻板角和边的永久的记号。同时作出溴酚蓝和二甲苯腈蓝位置的记号。
通常 2~10 min 的曝光足够得到放射标记探针的图像。
12. 分开玻璃板和胶片,用手术刀除去放射标记的条带。将切过的胶在一张新的胶片上曝光,以保证含有正确分子大小条带的凝胶区域确实被切下来。
13. 将切下的凝胶片段转入灭菌的微离心管中,加入恰好足够体积的凝胶洗脱缓冲液盖住凝胶(250~500 μl)。将盖上的离心管在摇床上室温过夜。
14. 最大转速离心 5 min。
15. 用自动的吸量装置将上清转入新的离心管中,注意不要吸入聚丙烯酰胺。标记的探针用液闪分光镜检测应为大约 10000 cpm/μl。
16. -70℃ 保存探针。

待测 RNA 和放射标记的 DNA 探针间的杂交
17. 将 0.5~150 μg 的 RNA ( 待测的和标准的)平均分入每一个灭菌的微型离心管中。向每一个管中加入过量的均匀标记的单链 DNA 探针。
18. 加入 10% 体积的 3 mol/L 醋酸钠(pH 5.2),2.5 倍体积的冰冷的乙醇,沉淀 RNA 和 DNA。0℃ 放置 30 min,最大转速 4℃ 离心 15 min 回收核酸。去除乙醇的上清,用 70% 的乙醇洗涤,再次离心。小心的除去所有的乙醇,将含有 RNA 和 DNA 的沉淀室温放置直至乙醇的残迹蒸发。

19. 用 30 μl 杂交缓冲液溶解核酸沉淀。吹吸几次以保证沉淀彻底溶解。
20. 将离心管的盖盖紧,将杂交反应在 85℃ 水浴温育 10 min 使核酸变性。
21. 快速将离心管转移到调至杂交温度(通常 65℃)的水浴中。转移过程中,不要让离心管冷却到低于杂交的温度。在选定的温度下,将 DNA 和 RNA 杂交 12~16 h。
S1 核酸酶消化 DNA-RNA 杂合体
22. 注意保持离心管浸没在水中,打开管盖。快速加入 300 μl 冰冷的 S1 核酸酶消化缓冲液,并立即将离心管从水浴中拿出。温和振荡以混匀离心管中物质,再将离心管转移到调至 S1 核酸酶消化温度的水浴中。根据所需要的消化程度,温育 1~2 h。

23. 将反应体系冷至 0℃。加入 80 μl S1 核酸酶终止缓冲液并振荡混匀溶液。
24. 用苯酚:氯仿萃取反应体系一次。反应体系在微型离心管中以最大转速室温离心 2 min,将上淸转到另一个离心管中。加入两倍体积的乙醇,混匀,-20℃ 放置 1 h。
25. 以最大转速 4℃ 离心 15 min 回收核酸。小心的除去所有的上清,将打开的离心管在室温放置直到可见的乙醇残迹蒸发掉。
用凝胶电泳分析 S1 核酸酶产物
26. 用 4 μl TE 缓冲液(pH 7.6) 溶解核酸沉淀。加入 6 μl 上样缓冲液并混匀。
27. 95℃ 温育核酸 5 min,立即转移到冰上。稍微离心使样品聚集在离心管的底部。
28. 用聚丙烯酰胺 8 mol/L 尿素的凝胶电泳检验放射标记的 DNA。
29. 当示踪染料在胶上移动了适当的距离后,关掉电源拆卸电泳装置。轻轻的橇开大玻璃板的一角并将大玻璃板从胶上移开。为确定方向,切下胶的一角。
30. 将含有胶的玻璃板转移到含过量的 10% 三氯乙酸的托盘中。室温下轻微晃动托盘 10 min。
31. 将 10% 的三氯乙酸溶液倒掉,换过量的 1% 三氯乙酸。室温摇动 5 min。
32. 倒掉 1% 的三氯乙酸溶液,用去离子水轻微的漂洗一下已被固定的胶。将玻璃板和胶一起拿出托盘,放在平的地方。用纸巾除去多余的水。
33. 剪下每一边都比胶长 1 cm 的 Whatman 3 MM 滤纸(或相同材料)。将纸置于胶的上面再将玻璃板颠倒过来从而把胶转移到滤纸上。
34. 移去玻璃板,把胶放在凝胶干燥器中 60℃ 干燥 1~1.5 h。
35. 获得干胶的放射自显影图。用光密度测定法或磷光成像法扫描图像,或者切下含有片段的凝胶用液闪分光光度计计量。





