巢式PCR在动物疾病诊断中的应用
简介
巢式 PCR 在动物疾病诊断中的应用是利用巢式 PCR 技术快速、准确地对动物的疾病做出诊断。
原理
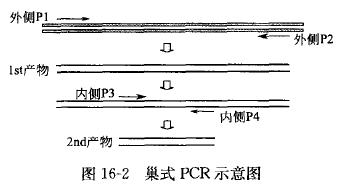
巢式 PCR 在动物疾病诊断中的应用的基本原理是利 用两套 PCR 引物对(巢式引物)进行两轮 PCR 扩增反应(见图 16-2), 借以提高扩增的灵敏性和 特异性。首先,以外引物(P1/P2)进行第一轮 扩增;再以第一轮扩增产物为模板,利用内引物(P3/P4)进行第二轮扩增。由于巢式 PCR 反应有两次扩增过程,因而增加了检测的敏感性;同时又因为使用了两对引物与检测模板配对,从而提高了检测的特异性。但是,两轮扩增会使检测 结果放大很多倍,如果一旦出现污染,容易产生假阳性,所以控制污染是该方法成败的关键。
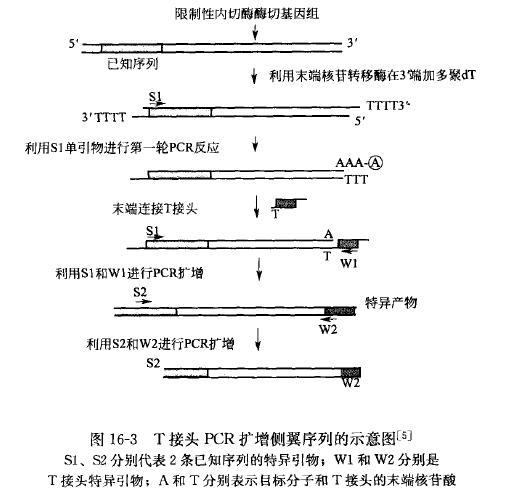
图解示意:
用途
巢式 PCR 在动物疾病诊断中的应用可用于
1. 无浆体病巢式 PCR 检测;
2. 西尼罗病毒病巢式 PCR 检测;
3. 弓形虫巢式 PCR 检测。
材料与仪器
器材:
PCR 扩增仪、凝胶成像分析仪(美国 BIORAD 公司)
试剂:
① DNA 提取试剂盒 DNAZol Reganet(Invitrogen)
② Tag 酶
③ dNTP
④ DNA-marker
⑤ 琼脂糖
⑥ 胰酶
⑦ 蛋白酶 K
步骤
巢式 PCR 在动物疾病诊断中的应用的基本过程可分为如下几步,以猪圆环病毒的检测为例进行介绍:
1、靶基因和引物设计
靶基因的选择原则主要包括:
①各菌毒种(或属)的扩增靶基因应具有种属特异性,即为种(或属)所共有且特异;
②靶基因与其它基因应没有或仅有很低的同源性。从 NCBI 上下载靶基因序列,利用 NTI9.0 进行同源性比对,选择具有种(或属)特异性的靶基因序列,利用 Primer5.0、Oligo6.0、Array Designer4.0 等基因软件进行引物设计。
2、模板制备
组织样品中加入 3 倍的 Hank's 液,充分研磨制成悬浮液,反复冻融 3 次,8000 r/min 离心 5 min,取上清 200 μl,加入 800 μl DNA Zol 室温放置 5 min, 12000 r/min 离心 10 min, 取 950 pl 上清,加入 500 μl 无水乙醇,放置 5 min, 10000 r/min 离心 5 min;去上清,用 1 ml 75% 乙醇洗涤,10000 r/ min 离心 3 min,去上清,室温干燥,最后用 200μl 的 8 mmol/L NaOH 溶解核酸,-20 ℃ 保存备用。
3、巢式 PCR 扩增
(1) 第一轮 PCR 扩增 PCR 反应体系为 25 μl, 反应成分如下:上下游引物 P1/P2 各 0. 5 μl、2.5 mmol/L dNTP 2 μl、10 × PCR 缓冲液 2.5 μl、25 mmol/L MgCl 23 μl、DNA 模板 3 μl、Taq 酶 0.2 μl (5 U/μl),用灭菌双蒸水补足。反应条件:95 ℃ 预变性 5 min;94 ℃ 变性 30 s,54 ℃ 退火 30 s, 72 ℃ 延伸 1 min,共进行 30 个循环;然后 72 ℃ 延伸 7 min。PCR 产物经 1.5%~2% 琼脂糖凝胶电泳检测。
(2)第二轮 PCR 扩增 PCR 反应体系为 25 μl,反应成分如下:上下游引物 P3/P4 各 0.5 μl、2.5 mmol/L dNTP 2 μl、10 × PCR 缓冲液 2.5 μl、25 mmol/L MgCl 23 μl、第一轮 PCR 扩增产物 1 μl(或 100 倍稀释)为模板、Taq 酶 0.2 μl (5 U/μl), 用灭菌双蒸水补足。反应条件: 95 ℃ 预变性 5 min; 94 ℃ 变性 30 s,55 ℃ 退火 30 s,72 ℃ 延伸 45 s,共进行 30 个循环;然后 72 ℃ 延伸 7 min。PCR 产物经 2% 琼脂糖凝胶电泳检测。
注意事项
1. 模板污染控制
巢式 PCR 方法极为敏感,因此在采样或检验过程中要十分小心,以免样品污染后产生假阳性结果。将样品的处理、配制 PCR 反应液、PCR 循环扩增及 PCR 产物的鉴定等步骤分区或分室进行;吸样枪吸样要慢,吸样时尽量一次性完成,忌多次抽吸,以免交叉污染或产生气溶胶污染;同时设立适当的阳性对照和阴性对照,阳性对照以能出现扩增条带的最低量的标准病原体核酸为宜,并注意交叉污染的可能性,每次反应都应有-管不加模板的试剂对照及相应不含有被扩增核酸的样品的阴性对照。
2. 退火温度的确定
退火温度的选择原则是在引物 Tm 值允许范围内,选择较高的退火温度。通常第一轮反应可选用较低退火温度,确保目的条带的扩增;第二轮反应可以选用较高退火温度,提高特异性,消除非特异性结合。但是在单管巢式 PCR 反应中两对引物在同一管中,第一轮用较高退火温度的外引物扩增目的片段,然后降低退火温度使内引物以第一轮的产物为模板进行巢式扩增,提高敏感性。
相关文章
- RT-PCR、Western blot和ELISA三者的区别
- PCR反应五要素
- 原位聚合酶链式反应(in situ PCR)和原位反转录聚合酶链式反应(in situ RT-PCR)操作规程
- A sensitive quantification of HHV-6B by real-time PCR
- PCR标准反应体系
- Validation of RNAi by Real Time PCR
- Site-Directed Mutagenesis and Gene Fusion by Megaprimer PCR
- 逆转录-聚合酶链反应 (Reverse Transcription-Polymerase Chain Reaction,RT-PCR
- 锚定PCR
- Real-Time PCR Fluorescent Chemistries