杆状病毒表达系统的建立
简介
杆状病毒是双链 DNA 病毒,主要感染昆虫,也感染体外昆虫细胞系,对人畜无毒害。苜蓿银纹夜蛾核型多角体病毒(AcMNPV)是目前宿主最广、应用最多的杆状病毒,它与草地贪夜蛾 Sf21 细胞系建立了广为应用的 Bac-to-Bac 杆状病毒表达系统。
该系统表达的外源基因,表达量多,能进行产物加工、修饰和折叠,形成有生物活性的产物,是当今基因工程领域中的四大表达系统之一,已表达上千种外源基因。
原理
Bac-to-Bac 系统的技术原理是该系统主要包括供体质粒 pFastBac,大肠杆菌 DH5a、DH10Bac,昆虫 Sf21 细胞等。供体质粒 pFastBac 上有 Tn7 的左右臂序列,两臂之间是病毒多角体基因 polyhedrin 的强启动子及其下游的多克隆位点、polyA位点,庆大霉素抗性基因等。
将外源基因连接到供体质粒上,转化 DH5a 感受态细胞,提取重组供体质粒,再转化 DH10Bac 感受态细胞。该细胞含有穿梭质粒 Bacmid 和辅助质粒 helper,Bacmid 上有 F 复制子,卡那霉素抗性基因及 lacZa 肽段编码基因,LacZa 基因上有细菌转座子 Tn7 的附着位点 mini-attTn7。重组供体质粒的 Tn7 在 DH10Bac 中 helper 编码的转座酶帮助下转座到 Bacmid 上的 mini-attTn7 位点,干扰了 LacZ 的表达。
因此具有重组 Bacmid 的 DH10Bac 在庆大霉素、卡那霉素、四环素(辅助质粒对四环素有抗性)及含有 X-gal、IPTG 的培养板上形成白色菌落。提取重组 Bacmid,脂质体法转染昆虫 Sf21 细胞,在培养液中可获得重组病毒,重组病毒可继续感染昆虫细胞,外源基因随着病毒扩增而表达。供体质粒 pFastBacDUAL 有两个克隆位点,一个位于 poly-hedrin 的启动子下游,一个位于 p10 启动子下游,用它构建的重组病毒感染细胞后表达两种蛋白。
有的学者把绿色荧光蛋白基因构建到 p10 启动子下游,表达的绿色荧光作为标记蛋白。
材料与仪器
器材:
① 细胞培养设备,恒温培养箱
② 相差显微镜
③ 离心机
试剂:
① 供体质粒 pFastBac 或 pFastBacDUAL,DH5aDH10Bac,感受态细胞 Sf21 细胞
② LB 液体、固体培养基、Luria 固体培养基、SOC 培养基、Grace's培养液
③ 限制性内切酶
④ 连接酶
⑤ 质粒提取试剂盒
⑥ lipofectin
步骤
昆虫杆状病毒表达系统的建立的基本过程可分为如下几步:
(一) 试剂配制
(1) LB 液体培养基:NaCl 10 g,酵母提取物 5 g,蛋白胨 10 g,然后用 NaOH 调节 pH 至 7.0,定容至 1000 mL,103.4 kPa 灭菌 20 min。LB 固体培养基:每升 LB 液体培养基补加琼脂粉 15 g,灭菌 20 min。
(2) Luria Agar 固体培养基:每升含胰化蛋白胨 10 g,酵母提取物 5 g,NaCl 10 g,琼脂粉 15 g,pH 7.0~7.2,15 lbf/in2,103.4 kPa 灭菌 20 min。
(3) SOC 培养基:先配 SOB 培养基:胰化蛋白胨 2 g,酵母提取物 0.5 g,NaCl 0.05 g,250 mmol/L KCl 溶液 1 mL,定容至 100 mL。然后用 NaOH 调 pH 至 7.0,10 lbf/in2,68.9 kPa 灭菌 30 min,4 ℃ 放置。用时在 10 mL SOB 培养基里加入灭菌的 50 μL 2mol/L 的 MgCl2 溶液及 200 μL 无菌抽滤的1 mol/L 葡萄糖。
(4) Grace's完全培养液:Grace's昆虫细胞培养基补加碳酸氢钠 0.35 g/L,lactalbuminhydrolysalate 及 yeastolate 各 3.33 g/L 后用超纯水充分溶解,1 mol/L NaOH 调 pH 至 6.0,定容 1 L,无菌抽滤后分装,-20 ℃ 存放。用时添加胎牛血清至 10%。
(二) 重组供体质粒构建
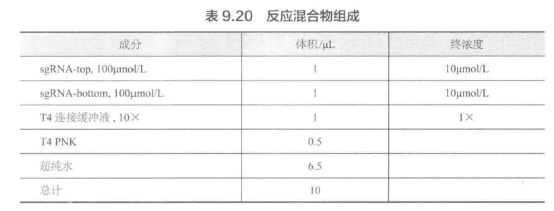
(1) 连接:选取限制性内切酶如 EcoRI/XhoI 分别酶切供体质粒和外源基因片段,T4 连接酶连接,16 ℃ 过夜。
(2) 转:DH5a 5 μL 连接液加入到 100 μL 冰浴融化的 DH5a 感受态细胞中,冰浴 30 min,42 ℃ 热激 60 s,冰上冷却 2 min,加入 400 μL SOC 培养基,37 ℃,225 r/min 振荡培养 1 h,离心收集细胞。用适量 SOC 培养基稀释菌体细胞,涂布在含氨苄青霉素 100 μg/mL,X-gal 100 μg/mL,IPTG 40 μg/mL 的 LB 固体培养基平板上,37 ℃ 倒置培养 24~48 h。
(3) 蓝白斑筛选:挑起平板中央数个独立白斑,PCR 及酶切验证是否重组了外源基因。
(4) 重组质粒提取:阳性白斑扩增培养,用质粒提取试剂盒提取重组的供体质粒。
(三) 转座获得重组 bacmid
(1) 转化:DH10Bac 1 μL 重组供体质粒稀释至 10 μL 水中后加入到 100 μL 冰浴融化的 DH10Bac 感受态细胞中,冰浴 30 min,42 ℃ 热激 45 s,冰上冷却 2 min。加入 900 μL SOC培养基,37 ℃,225 r/min 振荡培养 4 h,离心收集细胞,用适量 SOC 培养基稀释菌体细胞。涂布在含卡那霉素 50 μg/mL,庆大霉素 7 μg/mL,四环素 10 μg/mL,X-gal 100 μg/mL,IPTG40 μg/mL 的 Luria 固体培养基平板上,37 ℃ 倒置培养 24~48 h。
(2) 蓝白斑筛选:挑起平板中央数个独立白斑,PCR 及酶切验证是否重组了外源基因。
(3) 重组质粒提取:阳性白斑扩增培养,用质粒提取试剂盒提取重组 bacmid。带 GFP 标记蛋白的重组 pFastBacDUAL。
(四) 转染
(1) 10 μL cellfectin 加无菌水至 25 μL,轻轻混匀 5 min。
(2) 将 60 ℃ 水浴 1 h(灭活微生物)的 25 μL 重组 Bacmid(对照组用不含外源基因的Bacmid 代替)加入脂质体中,室温 1 h,期间每隔 10 min 轻弹管底混匀一次。
(3) 将指数生长期的 Sf21 细胞的含血清培养液换成 2 mL 无血清 Grace's 培养液,1 h 后更换 2 mL 新的无血清 Grace's 培养基。并将上述 Bacmid/脂质体混合物轻轻点在培养基上,27 ℃ 静置培养 5~6 h 后,换 2 mL 含 50 U/mL 庆大霉素和 10% 胎牛血清的 Grace's 完全培养液。
(4) 27 ℃ 继续培养 3~5 d 后收集上清培养液,4 ℃ 避光存放,以备感染用。
(五) 感染扩增、收集重组蛋白
(1) Sf21 细胞生长至 80% 密度时,弃培养液,加入上述收集的转染后含重组病毒的上清培养液。
(2) 27 ℃ 静置培养 1.5 h 后,更换 4 mL 新的 Grace 培养液继续培养 3~5 d,分别收集上清(含芽生病毒 Budded virus,BV)及细胞,进行重组表达产物的纯化及鉴定。
(3) 上清中含重组病毒芽生病毒,可离心弃细胞碎片后继续用于感染。
(六)重组蛋白的检测 SDS-page 或 Western blotting 法检测
注意事项
(1)扩增的外源基因的 PCR 产物两端要有限制性内切酶位点序列,且该序列应与将要连接的供体质粒的限制性内切酶序列一致。
(2)转化 DH5a 及 DH10Bac 固体培养基平板上的抗生素及 X-gal、IPTG 要涂布均匀,然后放至培养箱半小时后才能使用,否则对菌体细胞毒性大,无法形成菌落。
(3)重组 Bacmid 在与脂质体混合前要用 60 ℃ 水浴灭活,以避免转染培养时污染。转染前 Sf21 细胞应换不含血清的 Grace's 培养液,1 h 后更换 2 mL 新的无血清 Grace's 培养基,再加入 Bacmid/脂质体混合物,否则转染率低。