DNA 测序(非同位素银染)
原理Promega公司的SILVER SEQUENCETM DNA测序系统是一种无放射性的序列分析系统,它通过灵敏的银染方法检测凝胶中的条带。 银染提供了一种对
原理
Promega公司的SILVER SEQUENCETM DNA测序系统是一种无放射性的序列分析系统,它通过灵敏的银染方法检测凝胶中的条带。 银染提供了一种对于放射性或荧光法来说更加快速,廉价的替代方法。测序结果可以在同一天内得到;电泳完成后经90分钟就可读序,这是常规的放射性测序法做不到的。 此外,SILVER SEQUENCETM系统用未修饰的5'OH寡聚核苷酸作为引物,减少了特殊修饰寡聚核苷酸的花费。该系统不需要放射性方法中对同位素的谨慎操作,也不需要荧光法或化学发光技术的昂贵试剂。另外,也不需要象大多数荧光法那样用仪器来检测序列条带。
Taq DNA聚合酶在95℃时极强的热稳定性。本系统利用的测序级Taq DNA聚合酶是一种Taq DNA聚合酶的修饰产品,对于双链DNA模板有非常好的效果,具有高度的准确性,能产生均一的条带,且背景低。
SILVER SEQUENCETM系统包含被修饰的核苷酸混合物,如7-去氮dGTP(7-deaza dGTP,或dITP)替代dGTP可清除由GC丰富区域所引起的条带压缩现象。
退火温度是热循环测序中最重要的因素。高退火温度可减少模板二级结构。提高引物结合模板配对的严谨性。链重退火和模板二级结构则限制了小片断PCR产物(<500bp)得到清楚的序列数据的能力。引物延伸起始于每个循环的退火阶段。在较低温度时,聚合酶可能会遇到坚固的二级结构区域,它可导致聚合酶解离。则在四个电泳道中均有同一相对位置的条带。因为这些原因,应该使用尽可能高的退火温度。对于有牢固二级结构的模板建议使用95℃变性、70℃退火/延伸的循环模式。一般来说,较长的引物及GC含量高的引物能得到较强的信号。实验结果表明,>24mer的GC含量约为50%的引物可得到最佳结果。
由于本系统采用热循环装置, 与常规的测序方法相比具有如下几点好处:(1).本方法线性扩增模板DNA产生足够的产物使银染技术能够检测序列条带,测序反应需要0.03~2pmol模板DNA,随模板种类而定。(2). 在每一个变性循环中的高温可以取代对双链DNA(dsDNA)模板的碱变性及乙醇沉淀过程,变性循环也有助于消除由于线性dsDNA模板(如PCR反应产物)快速重退火所引起的问题。(3). 高温聚合酶反应减弱了DNA模板的二级结构,允许聚合酶穿过高度二级结构化的区域。
材料与仪器
DNA
DNA测序试剂盒 丙烯酰胺 冰乙酸 乙醇 超纯水 硫代硫酸钠 甲叉双丙烯酰胺 碳酸钠 甲醛 硝酸银 双蒸水 冰醋酸 硼酸 EDTA 过硫酸铵 TBE电极缓冲液
高压电泳仪 测序用电泳槽 制胶设备 PCR仪 棕色瓶 冰箱
DNA测序试剂盒 丙烯酰胺 冰乙酸 乙醇 超纯水 硫代硫酸钠 甲叉双丙烯酰胺 碳酸钠 甲醛 硝酸银 双蒸水 冰醋酸 硼酸 EDTA 过硫酸铵 TBE电极缓冲液
高压电泳仪 测序用电泳槽 制胶设备 PCR仪 棕色瓶 冰箱
步骤
一、试剂准备
1. SILVER SEQUENCETM DNA测序试剂盒。
2. 丙烯酰胺和甲叉双丙烯酰胺储备液(38%丙烯酰胺 W/V,2%甲叉双丙烯酰胺 W/V):95 g丙烯酰胺,5 g甲叉双丙烯酰胺溶于140 ml 双蒸水中,定容至250 ml,0.45 mm过滤器过滤后,贮于棕色瓶中,置于4℃冰箱可保存2周。
3. 10%过硫酸铵,0.5 g过硫酸铵溶于4 ml水中,定容至5 ml,应新配新用。
4. 10xTBE缓冲液(1 mol/L Tris, 0.83mol/L 硼酸,10 mmol/L EDTA): 121.1 g Tris,51.35 g硼酸,3.72 g Na2EDTA·2H2O,溶于双蒸水中定容至1升,置于4℃下可贮存2周,其pH约为8.3。
5. TBE电极缓冲液:10xTBE 缓冲液稀释至1xTBE备用。
6. TEMED
7. 固定/停止溶液:10%冰醋酸(V/V)配制2升备用。
8. 染色溶液:硝酸银2 g,甲醛3 ml,溶于2升超纯水中备用。
9. 显影溶液:60 g碳酸钠(Na2CO3)溶于2升超纯水中,使用前加3 ml 37%甲醛和40 ml硫代硫酸钠溶液(10 mg/ml)。
10. 95%乙醇。
11. 0.5%冰乙酸。
12. Sigmacote (Sigma CAT. #SL-2)。
二、测序反应
1. 对于每组测序反应,标记四个0.5 ml eppendorf管(G、A、T、C)。每管加入2 ml适当的d/ddNTP混合物(d/ddNTP Mix)。各加入1滴(约20 ul)矿物油,盖上盖子保存于冰上或4℃备用。
2. 对于每组四个测序反应,在一个eppendorf管中混合以下试剂:
(1) 样品反应:
质粒模板DNA :2.1 pmol
5x测序缓冲液 : 5 ml
引物: 4.5 pmol
无菌ddH2O 至终体积16 ml
(2)对照反应
pGEM-3Zf(+)对照DNA(4 mg) :4.0 ml
5x测序缓冲液: 5 ml
pUC/M13正向引物(4.5 pmol) :3.6 ml
3. 在引物/模板混合物(以上第2步)中加入1.0 ml测序级Taq DNA聚合酶(5 u/ml)。用吸液器吸动几次混匀。
4. 从第3步的酶/引物/模板混合物中吸取4 ml加入每一个d/ddNTP混合物的管内。
5. 在微量离心机中离心一下,使所有的溶液位于eppendorf管底部。
6. 把反应管放入预热至95℃的热循环仪,以【注意】中循环模式为基准,开始循环程序。对于每个引物/模板组合都必须选择最佳退火温度。下列程序一般能读出从引物开始350碱基的长度。
7. 热循环程序完成后,在每个小管内加入3 ul DNA测序终止溶液,在微量离心机中略一旋转,终止反应。
【注意】
(1)测序所用模板DNA的量一般按下面要求加入:
模板种类/长度 模板量
200 bp(PCR产物):16 ng(120 fmol)
3000~5 000 bp(超螺旋质粒DNA): 4 mg(2 pmol)
48 000 bp(λ,粘粒DNA): 1 mg(31 fmol)
由于超螺旋质粒产生的信号比松驰的线性双链DNA弱,因此使用超螺旋质粒作为模板时其用量要比其它模板大一些。
(2)计算与4.5 pmol相当的引物纳克数可用以下一般公式:
4.5 pmol=1.5 ngxn,其中n为引物碱基数
计算与1p mol相当的引物微克数可用以下一般公式:
dsDNA:1 pmol=(6.6x10-4 mg)xn,其中n为模板碱基对数
ssDNA:1pmol=(3.3x10-4 mg)xn,其中n为模板碱基数
(3)为阻止Taq DNA聚合酶延伸非特异性退火引物, 热循环仪必须预热至95℃。温度变换应越快越好。下面的循环时间不包括变温时间。如果你无法确定使用何种模式,建议从模式1开始。
模式1:适用于引物<24碱基或GC含量<50%
95℃ 2分钟,然后: 95℃ 30秒(变性),42℃ 30秒(退火),70℃ 1分钟(延伸)。
模式2:适用于≥24碱基或略短的GC含量≥50%的引物。
95℃ 2分钟,然后:95℃ 30秒(变性),70℃ 30秒(退火/延伸)。
(4)在加入终止溶液之后样品可在4℃保存过夜。
三、测序凝胶板的制备
1. 玻璃板的处理
银染测序的玻璃板一定要非常清洁,一般先用温水和去污剂洗涤,再用去离子水冲洗玻璃板,除去残留的去污剂,最后用乙醇清洗玻璃板。玻璃板上遗留的去污剂微膜可能导致凝胶染色时背景偏高(棕色)。短玻璃板经粘合溶液处理可将凝胶化学交联于玻璃板上。这一步对于在银染操作过程中防止凝胶撕裂至关重要。
(1)短玻璃板的处理
① 在1 ml95%乙醇,0.5%冰乙酸中加入5 ml粘合硅烷(Bind Silane),配成新鲜的粘合溶液。
② 用经浸透新配的粘合溶液浸透的吸水棉纸擦拭仔细清洗过并已经自然干燥的玻璃板,整个板面都必须擦拭。
③ 4~5分钟后,用95%乙醇单向擦玻璃板,然后略用力沿垂直方向擦拭。重复三次这一清洗过程,每次均须换用干净的纸,除去多余的粘合溶液。
【注意】
① 在95%乙醇单向擦玻璃板时过度用力会带走过多的粘合硅烷,使凝胶不能很好地粘附。
② 准备长玻璃板之前要更换手套,防止粘染粘合硅烷。
③ 防止粘合溶液沾染在长玻璃板上是很重要的,否则将导致凝胶撕裂。
(2)长玻璃板的处理:
① 用浸透Sigmacote溶液的棉纸擦拭清洗过的长玻璃板。
② 5~10分钟后用吸水棉纸擦拭玻璃板以除去多余的Sigmacote溶液。
【注意】
① 用过的凝胶可在水中浸泡后用剃须刀片或塑料刮刀刮去。玻璃板须用去污剂完全清洗。或者凝胶用10%NaOH浸泡后除去。为防止交叉污染,用于清洗短玻璃板的工具必须与清洗长玻璃板的工具分开,如果出现交叉污染,以后制备的凝胶可能撕裂或变得松驰。
2. 凝胶的制备
(1)玻璃板经粘合硅胶和Sigmacote处理后,即可固定玻璃板。该方法是用0.2 mm或0.4 mm厚的边条置于玻璃板左右两侧,将另一块玻璃板压于其上。在长玻璃板的一侧插入鲨鱼齿梳平的一面边缘,用夹子固定住。
(2)根据所需要的凝胶浓度,按下表制备测序凝胶,一般6%~8%的胶浓度可获得较好的结果。配制过程中,先用适量双蒸水溶解尿素,再加入Acr&Bis和10xTBE缓冲液,再用双蒸水调终体积至99.2 ml,并用0.45 mm的滤膜过滤,然后加过硫酸铵和TEMED。溶解尿素时不必加热。如果确需加热则应等溶液完全冷却后,方可加入TEMED和过硫酸铵。一般在胶灌制后4~6分钟,即开始聚合,如果聚合不好,则应使用高浓度的TEMED和过硫酸铵。
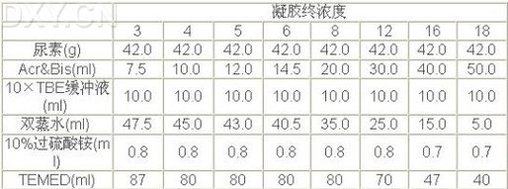
(3)胶配制好后,即可灌制胶板。一般是将凝胶沿着压条边缘缓慢地倒入玻璃板的槽中,倒完后,静止放置使之聚合完全。
【注意】
① 使用夹子固定玻璃板时,最好夹子的力量稍大一些,防止因力量不足使灌胶的过程中出现漏胶液现象。
② 灌制凝胶的过程中要严防产生气泡,否则影响测序的结果。
四、电泳
1. 预电泳
(1)当凝胶聚合完全后,拨出鲨鱼齿梳,将该梳子反过来,把有齿的一头插入凝胶中,形成加样孔。
(2)立即将胶板固定在测序凝胶槽中,一般测序凝胶槽的上下槽是分开的,因而只有在固定好凝胶板后,方能加入TBE缓冲液。
(3)稀释10xTBE缓冲液至1xTBE,将该缓冲液加入上下二个电泳槽中,去除产生的气泡,接上电源准备预电泳。
(4)有些电泳槽,如LKB的Macrophor等是使用水浴加热的,则应先将水浴加热至55℃后进行预电泳。有的不使用水浴加热,依靠电泳过程中自身产生的热进行保温,如上海求精有机玻璃仪器生产的测序电泳槽,这种槽需夹上二块散热铝板,使整个凝胶板的温度一致。
(5)按30 V/cm的电压预电泳20~30分钟。预电泳的过程是去除凝胶的杂质离子,同时使凝胶板达到所需的温度。高温电泳可防止GC丰富区形成的发夹状结构,影响测序的结果。
【注意】
① 用鲨鱼齿梳制作加样孔时,应注意将齿尖插入胶中0.5mm左右,千万注意不能使加样孔渗漏,否则得不到正确的结果。
② 应时刻注意上面电泳槽中的缓冲液是否渗漏,否则极易造成短路而损坏电泳仪。
2. 样品的制备
当在预电泳时,即可进行样品的制备,将反应完毕的样品在沸水浴中加热1~3分钟,立即置于冰上即可。如果样品长时间不用,则应重新处理。可使用4~6%聚丙烯酰胺凝胶,胶厚0.4 mm。厚度小于0.4 mm的胶可能导致信号太弱。加样时不必吸去上层覆盖的矿物油,但要小心地吸取矿物油下的蓝色样品。
3. 上样及电泳
关闭电泳仪,用移液枪吸缓冲液清洗样品孔,去除在预电泳时扩散出来的尿素,然后立即用毛细管进样器吸取样品,加入样品孔中。上样顺序一般为G、A、T、C。加样完毕后,立即电泳。开始可用30 V/cm进行电泳,5分钟后可提高至40~60 V/cm,并保持恒压状态。一般来说,一个55 cm长,0.2 mm厚的凝胶板,在2500 V恒压状态下电泳2小时即可走到底部,同时在电泳过程中,电流可稳定地从28 mA降至25 mA。为了能读到更长的序列,可采用两轮或多轮上样。
【注意】
① 上样电泳时,一定要注意凝胶板的温度是否达到55℃左右,如果还没有达到,则应等温度达到后才能上样电泳。
② 一般来说电泳时,不宜使用太高的电压,因为太高的电压会使凝胶的分辨率降低,并且使带扩散。电泳中可进行恒功率电泳。
五、测序凝胶的银染
染色过程要求凝胶浸在塑料盘中。因而至少使用两个盘子,大小与玻璃板类似。在盘中加入新鲜溶液之前须用高质量的水洗涤盘子。
1. 电泳完毕后用一个塑料片子小心地分开两板,凝胶应该牢固地附着在短玻璃板上。
2. 固定凝胶:将凝胶(连玻璃板)放入塑料盘,用固定/停止溶液浸没,充分振荡20分钟或直至样品中染料完全消失,胶可在固定/停止溶液中保存过夜(不振荡)。保留固定/停止溶液,用于终止显影反应。
3. 洗胶:用超纯水振荡洗胶3次,每次2分钟。从水中取出,当转移至下一溶液时拿着胶板边沿静止10~20秒,使水流尽。
4. 凝胶染色:把凝胶移至染色溶液充分摇动30分钟。
5. 凝胶显影
(1)在显影溶液中加入甲醛(3 ml)和硫代硫酸钠溶液(400 ul)以完成显影液的配制。
(2)从染色溶液中取出凝胶放入装有超纯水的盘中浸洗5~10秒。注意,把凝胶从超纯水转移到显影溶液的总时间不能长于5~10秒。浸泡时间过长则导致信号微弱或丧失信号。若浸泡时间过长,可重复第五步用染色液浸泡。
(3)立刻将凝胶转移至1升(总量的一半)预冷的显影液充分振荡直至模板带开始显现或开始出现第一批条带,把凝胶移入剩下的1升显影液中继续显影2~3分钟或直至所有条带出现。
6. 固定凝胶:在显影液中直接加入等体积的固定/停止溶液。停止显影反应,固定凝胶。
7. 在超纯水中浸洗凝胶两次,每次2分钟,注意在本操作中戴手套拿着胶板边缘避免在胶上印上指纹。
8. 将凝胶置于室温干燥或用抽气加热法干燥。在可见光灯箱或亮白,黄色背景(如纸)上观察凝胶,若需永久保存的记录, 则可用EDF胶片保留实验结果。
【注意】
测序产物的银染是显现序列信息的一种新方法,本系统的成败受几个因素的影响。
① 水的质量对于染色的成功极其重要。超纯水(NANOpureR或Milli-QR的水)或双蒸水可获得较好的效果,如果水中有杂质,则低分子量条带可能无法出现。
② 碳酸钠也非常重要。使用新鲜的,美国化学学会级碳酸钠较好,如Fisher和Kodak ACS试剂级碳酸钠(Fisher Cat #S263-500或S262-3,或Kodak Cat #109-1990),一般可获得较好的结果。
③ 色后的洗涤步骤是非常关键的。如果凝胶洗涤时间太长,银颗粒会脱离DNA,产生很少或没有序列信号。如果洗涤时间过长,染色步骤可以重新进行。
④ 如果凝胶厚度超过0.4 mm或丙烯酰胺浓度高于4~6%,则有必要延长固定和染色的时间。如果凝胶比0.4 mm薄,染色反应后的洗涤必须缩短至不超过5秒。
⑤ 在室温下进行所有步骤,显影反应除外。显影溶液必须预冷至10~12℃以减小背景杂色。注意:临用前在显影溶液中加入甲醛和硫代硫酸钠。用新配的染色及显影溶液。不要重复使用任何溶液。
六、EDF胶片显影
使用EDF胶片可增强测序条带的对比度,如果测序胶上条带很淡,我们建议把数据转移至EDF胶片,银染胶在其影像转移至EDF胶片之后可增强条带可读性。
1. 在暗室内,将染色过的粘于玻璃板的凝胶(胶面向上)置于荧光灯箱上。如有合适的漫射板,亦可用白灯箱,为确保曝光时间,用一小条EDF胶片曝光不同时间,检查不同的曝光强度,一般曝光20~40秒可得较好结果。
2. 在红灯下找到EDF胶片有缺刻的一角,然后把胶片置于凝胶上,使缺口位于左上角。由于EDF胶片是单面的,因此必须确保缺口在左上角。
3. 在EDF胶片上放置一干净、干燥的玻璃板,开亮灯箱约20秒。
4. 用冲显放射自显影胶片的步骤手工显影EDF胶片,可使用下列操作过程:
(1) 在Kodak GBX显影液中显影1~5分钟;
(2) 水洗1分钟;
(3)在Kodak GBX定影液中定影3分钟;
(4)水洗1分钟。
【注意】
① 进行EDF胶片显影之前凝胶必须完全干燥。戴手套进行操作,以免印上指纹。同时注意EDF胶片不能用自动胶片处理器。
② 对于不同的光源最佳曝光时间可能不同,通过对一小条EDF胶片曝光不同时间以选择你所用光源的最佳曝光时间,参阅胶片说明书。
③ 曝光时间短则EDF胶片影像较深,曝光时间长则有助于减弱背景。
注意事项
一、操作须知
成功地使用银染测序系统需要对提供的操作方法进行仔细考虑。银染不如放射性检测法灵敏,而需要更多的模板量,此外,也不可能通过延长X光胶片曝光时间的方法增加信号强度。因此,请使用推荐的DNA模板量, 每次均使用所提供的对照检查系统的可靠性,并且注意如下几点:
1. DNA的浓度和纯度必须经过琼脂糖凝胶电泳或荧光法测定,样品应与已知量DNA一起电泳。
2. 分光光度法对于很多DNA提取物包括质粒小量制备来说,并不能给出一个可信的DNA浓度估计,混杂的染色体DNA、蛋白、RNA、有机物及无机化合物均可能有260nm光吸收。因此,分光光度法常常错误地高估DNA浓度。
3. DNA制备过程中用核糖核酸酶处理所产生核糖核苷酸,虽然它们在电泳后DNA样品的前面,并不能观察到,但它们仍会有260nm光吸收。




