Topo 克隆
简介
是一种基于转座子元件的 DNA 插入方法,适用于插入小片段的 DNA 序列(约为 4~5 kb)。
原理
TOPO 克隆技术是基于一个特殊的转座子序列—— pUC18/19 载体、转座酶和 DNA 聚合酶的相互作用。该技术的原理是将目标 DNA 片段与 TOPO 载体中带有转座子的插入位点 pUC18/19 连接,形成原始克隆。转座酶可以将插入片段与载体 DNA 之间的磷酸二脂酯键水解,然后将目标 DNA 片段与载体的 3'端羟基连接起来。DNA 聚合酶会将空位点的转座子序列填充,形成状如环形的新载体。通过转化大肠杆菌,重新生长和筛选细菌,可以获得目标 DNA 的克隆。TOPO 克隆技术是通过 TOPO 载体上偶联的异构酶(Topoisomerase)实现插入片段的快速克隆。不同于传统的 TA 克隆,TOPO 克隆技术能够在 2~5 min 内快速完成插入片段和载体的连接反应,操作简单,连接效率极高,克隆阳性率接近 100%。克隆原理是 TOPO 载体两端通过磷酸键偶联 TOPO 酶,连接反应时,受插入片段的 5'端羟基的攻击,磷酸键释放能量。利用该能量,插入片段 5'端羟基与载体片段 3'端磷酸基团连接在一起,TOPO 异构酶从载体分子上脱落,完成连接反应。
用途
分离目标 DNA 序列、构建表达载体和编制畜牧作物遗传图谱等方面。
材料与仪器
1、DNA 片段:平末端 DNA 或 PCR 产物。
2、TOPO 克隆 Kit:Zero Blunt TOPO PCR Cloning Kit(Invitrogen, Cat: K2800-20)。
3、大肠杆菌感受态: Top10。
4、抗生素:含有适合所选载体的抗生素,如 Zeocin。
步骤
1、选取合适的载体和目标 DNA:选择合适的载体和目标 DNA 是 TOPO 克隆的第一步。常用的载体包括 pCR2.1-TOPO、pCR4-TOPO 等,目标 DNA 可以是 PCR 扩增产物或者 DNA 平末端片段。
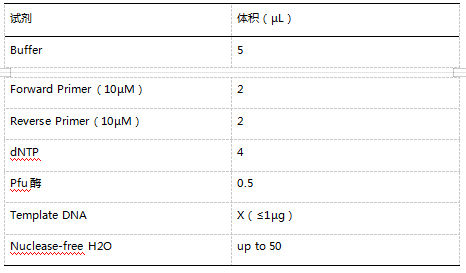
2、按下述体系配置溶液,室温孵育 5 分钟(22 ℃~23 ℃)。
反应体系
| 试剂 | 体积 |
| PCR 产物 | 0.5~4 μL |
| Buffer | 1 μL |
| 水 | 保持体积达到5 μL |
| Pcrii-Blunt-TOPO | 1 μL |
| 终体积 | 6 μL |
3、将混合物转化到大肠杆菌感受态细胞:用热激转化法将反应混合物转化到大肠杆菌细胞中。
4、将细菌涂布到含有抗生素的固体培养基上:将细菌涂布到含有适当抗生素的固体培养基上,放置在 37 ℃ 下培养过夜。
5、筛选重组菌落:根据抗生素的抗性判断是否有重组菌落出现。取出重组菌落进行 PCR 检测。
6、测序验证:对 TOPO 克隆所得的重组 DNA 进行测序验证,确认目标 DNA 被正确克隆。
总之,TOPO 克隆是一种快速、易操作、高效的 DNA 克隆技术,可用于高通量克隆和高效转化重组 DNA。
注意事项
1、目标 DNA 片段的长度不宜超过 5 kb。
2、TOPO 载体应该符合所选目标 DNA 的需求。
3、转化后的细菌需要进行筛选和鉴定,以确保筛选到的克隆具有需要的目标基因。
4、纯化时应注意避免 DNA 的氧化降解。