定量PCR
原理定量PCR(即时聚合酶链锁反应,Real-time Polymerase Chain Reaction,简称 Real-time PCR、即时PCR),又称
原理
定量PCR(即时聚合酶链锁反应,Real-time Polymerase Chain Reaction,简称 Real-time PCR、即时PCR),又称定量即时聚合酶链锁反应(Quantitative real time polymerase chain reaction,简称 Q-PCR/qPCR/rt-qPCR、定量即时PCR、即时定量PCR),是一种在DNA扩增反应中,以萤光染剂侦测每次聚合酶链锁反应(PCR)循环后产物总量的方法技术。
材料与仪器
限制性内切核酸酶 反转录酶 热稳定 DNA 聚合酶 dCTP 靶核酸
扩增缓冲液 dNTP 贮存液 胎盘 RNase 抑制剂
琼脂糖凝胶或聚丙烯酰胺凝胶 屏蔽型枪头 离心管 正向排液式移液器 PCR 仪
扩增缓冲液 dNTP 贮存液 胎盘 RNase 抑制剂
琼脂糖凝胶或聚丙烯酰胺凝胶 屏蔽型枪头 离心管 正向排液式移液器 PCR 仪
步骤
一、材料
1. 缓冲液与溶液
10X 扩增缓冲液
4 种 dNTP 贮存液(20 mmol/L,pH 8.0)
MgCl2 ( 50 mmol/L)
胎盘 RNase 抑制剂(20 单位/ul)
2. 酶与缓冲液
合适的限制性内切核酸酶
反转录酶(100~200 单位/ul)
热稳定 DNA 聚合酶
3. 放射性物质
[α-32P] dCTP(放射性比活度:3000 Ci/mmol) 的浓度为 10 mCi/mI
4. 凝胶
琼脂糖凝胶或聚丙烯酰胺凝胶
5. 核苷酸与寡核苷酸
外加已知含量的参考分子(DNA 或 RNA )
正向引物(20 umol/L)与反向引物(20 umol/L)溶于水
靶核酸
6. 专用设备
自动微量移液器的屏蔽型枪头
离心管(0.5 ml,薄壁扩增反应专用离心管)
正向排液式移液器
PCR 仪
二、方法
参考模板的制备
1. 应用本方案引言中设计与制备参考模板的方针来设计与制备适合于本项任务的参考模板。要尽可能仔细地测定参考模板的浓度,最好用荧光剂来测定。另一种方法是进行凝胶电泳和溴化乙锭(EB ) 染色后估算参考模板的含量。
2. 用水作一 10 倍稀释系列,参考模板浓度从 10-6 至 10-12 mol/L。在步骤 3 应用这些稀释液后,应将这些稀释液在使用后放置在 -70℃ 保存,以备步骤 8 使用。切记用水而不是用 TE 作溶剂,已防止改变 PCR 中镁离子的浓度。
cDNA 样品的制备
3. 如果起始分子是 RNA,对于这种靶 RNA 分子在 75℃ 温育 5 min,使其变性,随后将样品管插入冰水中加速冷却。然后,在 0.5 ml 离心管中立即建立系列的反转录反应,反应液中含有呈一定梯度的参考模板。在这些系列反应管的每一支管内加如下试剂:
10X 扩增缓冲液 2 ul
20 mmol/L 4 种 dNTP 混合液 1 ul
20 umol/L 反义引物 2.5 ul
约 20 单位/ul 胎盘 RNase 抑制剂 1 ul
50 mmol/L MgCl2 1 ul
变性靶 RNA 10 pg~1.0 ug
100~200 单位/ul 反转录酶 1 ul
10 倍稀释的参考模板 1 ul
H2O 补足至 20 ul
转录酶发挥作用需要 MgCl2。
反应管在 37℃ 水浴上温育 60 min;然后将样品管加热至 95℃,放置 20 min,使反转录酶变性灭活。
靶核酸分子与参考分子的扩增
4. 用 0.5 ml 灭菌离心管、扩增管或灭菌微量滴定板,将步骤 3 中建立的系列反应管的每一只管内依次加入如下试剂,建立扩增反应:
反转录反应(步骤 3)祥品或靶 DNA 样品 5 ul
20 umol/L 正义引物 1.5 ul
20 umol/L 反义引物 1.25 ul
10X 扩增缓冲液 5 ul
[α-32P] dCTP(3000 Ci/mmol) 10 uCi
20 mmol/L 4 种 dNTP 混合液 1 ul
Taq DNA 聚合酶 2 单位
H2O 补足至 50 ul
5. 如果 PCR 仪没有配制加热盖,在反应混合液的上层应加入一滴矿物油(约 50 ul),防止样品在 PCR 反应多个加热与冷却的循环过程中蒸发。另一种可选择的方法是,如果应用热启动 PCR 程序,在反应混合液的上层加一滴石蜡油。放置离心管或微量滴定板在 PCR 仪上。
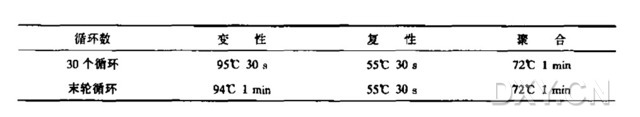
6. 按以下方法进行 PCR 扩增。典型的程序有变性、复性和聚合(延伸反应);相应的循环条件与温度列表如下:
PCR 产物的检测和定量
目前已有许多种方法能应用于 PCR 扩增产物的检测和定量。这些方法包括固相分析,阴离子交换高效液相色谱法(HPLC) 和扩增核酸分子的荧光标记法(Reischl and Kochamvski 1995)。然而,这些如此深奥的专门化技术既不能广泛应用也无严格的必要性。应用基于凝胶电泳的更加标准化的一些方法也能够获得精确的结果,譬如,应用荧光标记引物,在对扩增产物用全自动 DNA 序列分析进行定量分析(Porcher et al.1992), 荧光计,计算机凝胶图像分析系统,其中凝胶用溴化乙锭或其他螯合染剂染色(Schneeberger et al. 1995; Tsai and Wiltbank 19%),或者在 PCR 扩增过程中跟踪测量其放射性活度。
7. 分析和测定扩增产物
(1) 在应用的参考模板分子与靶序列之间存在大小差异的时候
① 从每只反应管中抽取 20 ul 样品,应用凝胶电泳和放射自显影分析扩增产物的大小。
② 从凝胶中回收参考模板和靶序列的扩增电泳条带,并用液体闪烁计数仅测定每条带的放射性活度。可选择的方法是,用合适的检测仪对电泳凝胶进行扫描分析 [ 如 Ambis 扫描仪或者磷光成像仪(phosphorimager)]
③ 计算每一 PCR 反应中两种放射性标记 DNA 的相对含量。
(2) 在所有参考模板中含用一个新的限制性酶切位点或缺失一个天然存在的酶切位点的时候
① 在扩增反应末轮循环结束后,在 94℃ 将样品加热 5 min。
② 使样品冷却至室温,再从各管中取 20 ul 反应液并用适当限制性内切核酸酶进行消化。
③ 用凝胶电泳和放射自显影分析扩增片段大小。
④ 从凝胶中回收参考模板和靶序列的扩增电泳条带,并用液体闪烁计数仪测定每条带的放射性活度。可供选择的方法是,用合适的检测仪对电泳凝胶进行扫描分析 ( 如 Ambis 扫描仪或者磷光成像仪)。
⑤ 计算每一 PCR 反应中两种放射性标记 DNA 的相对含量。
8. 根据测定结果,确定可与靶序列扩增产物几乎相等的参考模板浓度。设立另一扩增反应系列(参见步骤 4),进一步缩小参考模板的浓度范围。除常规成分外,这一系列反应还应包括:稀释度连续递增的参考模板(1:10,2:10,3:10,4:10 等)。
9. 重复步骤 5, 6 和 7。测定每一扩增反应中参考模板与靶序列的扩增产率之比,以该比例对每一个扩增反应中所加参考模板量作图,从所得直线上找出相应的点(即反应中得到与靶序列完全相等量的扩增产物的参考模板量)。计算初始样品中靶序列的浓度。
1. 缓冲液与溶液
10X 扩增缓冲液
4 种 dNTP 贮存液(20 mmol/L,pH 8.0)
MgCl2 ( 50 mmol/L)
胎盘 RNase 抑制剂(20 单位/ul)
2. 酶与缓冲液
合适的限制性内切核酸酶
反转录酶(100~200 单位/ul)
热稳定 DNA 聚合酶
3. 放射性物质
[α-32P] dCTP(放射性比活度:3000 Ci/mmol) 的浓度为 10 mCi/mI
4. 凝胶
琼脂糖凝胶或聚丙烯酰胺凝胶
5. 核苷酸与寡核苷酸
外加已知含量的参考分子(DNA 或 RNA )
正向引物(20 umol/L)与反向引物(20 umol/L)溶于水
靶核酸
6. 专用设备
自动微量移液器的屏蔽型枪头
离心管(0.5 ml,薄壁扩增反应专用离心管)
正向排液式移液器
PCR 仪
二、方法
参考模板的制备
1. 应用本方案引言中设计与制备参考模板的方针来设计与制备适合于本项任务的参考模板。要尽可能仔细地测定参考模板的浓度,最好用荧光剂来测定。另一种方法是进行凝胶电泳和溴化乙锭(EB ) 染色后估算参考模板的含量。
2. 用水作一 10 倍稀释系列,参考模板浓度从 10-6 至 10-12 mol/L。在步骤 3 应用这些稀释液后,应将这些稀释液在使用后放置在 -70℃ 保存,以备步骤 8 使用。切记用水而不是用 TE 作溶剂,已防止改变 PCR 中镁离子的浓度。
cDNA 样品的制备
3. 如果起始分子是 RNA,对于这种靶 RNA 分子在 75℃ 温育 5 min,使其变性,随后将样品管插入冰水中加速冷却。然后,在 0.5 ml 离心管中立即建立系列的反转录反应,反应液中含有呈一定梯度的参考模板。在这些系列反应管的每一支管内加如下试剂:
10X 扩增缓冲液 2 ul
20 mmol/L 4 种 dNTP 混合液 1 ul
20 umol/L 反义引物 2.5 ul
约 20 单位/ul 胎盘 RNase 抑制剂 1 ul
50 mmol/L MgCl2 1 ul
变性靶 RNA 10 pg~1.0 ug
100~200 单位/ul 反转录酶 1 ul
10 倍稀释的参考模板 1 ul
H2O 补足至 20 ul
转录酶发挥作用需要 MgCl2。
反应管在 37℃ 水浴上温育 60 min;然后将样品管加热至 95℃,放置 20 min,使反转录酶变性灭活。
靶核酸分子与参考分子的扩增
4. 用 0.5 ml 灭菌离心管、扩增管或灭菌微量滴定板,将步骤 3 中建立的系列反应管的每一只管内依次加入如下试剂,建立扩增反应:
反转录反应(步骤 3)祥品或靶 DNA 样品 5 ul
20 umol/L 正义引物 1.5 ul
20 umol/L 反义引物 1.25 ul
10X 扩增缓冲液 5 ul
[α-32P] dCTP(3000 Ci/mmol) 10 uCi
20 mmol/L 4 种 dNTP 混合液 1 ul
Taq DNA 聚合酶 2 单位
H2O 补足至 50 ul
5. 如果 PCR 仪没有配制加热盖,在反应混合液的上层应加入一滴矿物油(约 50 ul),防止样品在 PCR 反应多个加热与冷却的循环过程中蒸发。另一种可选择的方法是,如果应用热启动 PCR 程序,在反应混合液的上层加一滴石蜡油。放置离心管或微量滴定板在 PCR 仪上。
6. 按以下方法进行 PCR 扩增。典型的程序有变性、复性和聚合(延伸反应);相应的循环条件与温度列表如下:

PCR 产物的检测和定量
目前已有许多种方法能应用于 PCR 扩增产物的检测和定量。这些方法包括固相分析,阴离子交换高效液相色谱法(HPLC) 和扩增核酸分子的荧光标记法(Reischl and Kochamvski 1995)。然而,这些如此深奥的专门化技术既不能广泛应用也无严格的必要性。应用基于凝胶电泳的更加标准化的一些方法也能够获得精确的结果,譬如,应用荧光标记引物,在对扩增产物用全自动 DNA 序列分析进行定量分析(Porcher et al.1992), 荧光计,计算机凝胶图像分析系统,其中凝胶用溴化乙锭或其他螯合染剂染色(Schneeberger et al. 1995; Tsai and Wiltbank 19%),或者在 PCR 扩增过程中跟踪测量其放射性活度。
7. 分析和测定扩增产物
(1) 在应用的参考模板分子与靶序列之间存在大小差异的时候
① 从每只反应管中抽取 20 ul 样品,应用凝胶电泳和放射自显影分析扩增产物的大小。
② 从凝胶中回收参考模板和靶序列的扩增电泳条带,并用液体闪烁计数仅测定每条带的放射性活度。可选择的方法是,用合适的检测仪对电泳凝胶进行扫描分析 [ 如 Ambis 扫描仪或者磷光成像仪(phosphorimager)]
③ 计算每一 PCR 反应中两种放射性标记 DNA 的相对含量。
(2) 在所有参考模板中含用一个新的限制性酶切位点或缺失一个天然存在的酶切位点的时候
① 在扩增反应末轮循环结束后,在 94℃ 将样品加热 5 min。
② 使样品冷却至室温,再从各管中取 20 ul 反应液并用适当限制性内切核酸酶进行消化。
③ 用凝胶电泳和放射自显影分析扩增片段大小。
④ 从凝胶中回收参考模板和靶序列的扩增电泳条带,并用液体闪烁计数仪测定每条带的放射性活度。可供选择的方法是,用合适的检测仪对电泳凝胶进行扫描分析 ( 如 Ambis 扫描仪或者磷光成像仪)。
⑤ 计算每一 PCR 反应中两种放射性标记 DNA 的相对含量。
8. 根据测定结果,确定可与靶序列扩增产物几乎相等的参考模板浓度。设立另一扩增反应系列(参见步骤 4),进一步缩小参考模板的浓度范围。除常规成分外,这一系列反应还应包括:稀释度连续递增的参考模板(1:10,2:10,3:10,4:10 等)。
9. 重复步骤 5, 6 和 7。测定每一扩增反应中参考模板与靶序列的扩增产率之比,以该比例对每一个扩增反应中所加参考模板量作图,从所得直线上找出相应的点(即反应中得到与靶序列完全相等量的扩增产物的参考模板量)。计算初始样品中靶序列的浓度。
注意事项
RT-qRCR影响分析可靠性关键点(Key point):
1.分析结果依赖于模板的数量、质量以及合理的检测方法设计
2.反转录反应的非标准化影响试验的稳定性
3.数据分析应该高度客观,如果不合理的分析,从分析结果中会得到混淆的错误结果,因此通过对RT-qPCR的每一组分进行质量评价以达到最小化变异性,最大化可重复性,而且还需要沿用一个通用的数据分析的指南。对基因表达分析的标准化的需要是与人类临床诊断分析相适应的。
常见问题
来源于分子克隆实验指南第三版」黄培堂等译。




