用大肠杆菌 Klenow 片段标记合成的寡核苷酸实验
材料与仪器甲酰胺加样缓冲液 大肠杆菌 DNA 聚合酶 IKlenow 片段 变性聚丙烯酰胺凝胶 寡核苷酸引物 寡核苷酸模板 [α-32P]dNTP磷荧光粘贴标签
材料与仪器
甲酰胺加样缓冲液 大肠杆菌 DNA 聚合酶 IKlenow 片段 变性聚丙烯酰胺凝胶 寡核苷酸引物 寡核苷酸模板 [α-32P]dNTP
磷荧光粘贴标签 水浴或模块
磷荧光粘贴标签 水浴或模块
步骤
材料
溶液和缓冲液
稀样贮存液至适当浓度。
甲酰胺加样缓冲液
10XKlenow 缓冲液
酶与缓冲液
大肠杆菌 DNA 聚合酶 IKlenow 片段
凝胶
变性聚丙烯酰胺凝胶
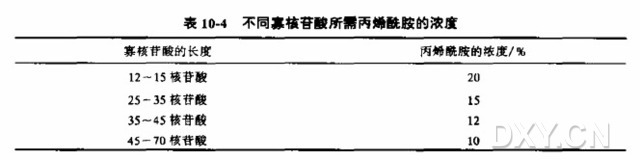
丙烯酰胺在凝胶溶液中的比例及电泳条件,依反应混合液中寡核苷酸的大小不同而异,表 10-4 列出一些有用的提示:
聚丙烯酰胺凝胶通常用 lxTBE(89 mmol/LTris-硼酸,2 mmol/LEDTA) 灌制。电泳亦在此缓冲液中进行。聚丙烯酰胺凝胶灌制的方法与操作详见方案 1 及第十二章的方案 8。
核酸和寡核苷酸
寡核苷酸引物
用方案 1 所述方法纯化引物。为确保有效地标记,反应液中引物浓度应 3~10 倍摩尔过量于 DNA 模板。
寡核苷酸模板
用方案 1 所述方法纯化寡核苷酸模板。寡核苷酸模板的序列应与所需的放射性标记探针的序列互补。
放射性化合物
[α-32P]dNTP
为保持反应底物的高浓度,应在尽可能小的体积中进行链延伸反应因此,最好使用溶于乙醇-水中的放射性标记 dNTP, 而不是溶于缓冲的水溶液中。适量体积的醇溶 [α-32P]dNTP 可在即将用于标记反应的微量离心管中混合及挥发干燥。为最大限度减少前体化合物及探针的放射分解,尽可能在 [32P]dNTP 到达的当天进行探针的放射性标记。
专用设备
磷荧光粘贴标签(有商品供应)或极热级放射性墨水粘贴标签放射性墨水是由少量 32P 与防水黑色绘图墨水混合而成。在本方案中使用的墨水为“极热级”(手提式小型探测器计数大于 2000cps), 用一纤维尖笔将墨水点于粘貼标签上。应在纤维尖笔上贴上放射性物质专用标志胶带,妥善保管。化学发光标签可替代放射性墨水,可以从 Stratagene(Glogos) 公司购买。
这种标签可反复使用多次,但在下一次放射自显影前须用荧光照射。
预溫至 80°C 的水浴或模块。
附加试剂
本方案步骤 9 所需要的试剂列于第 5 章的方案 12。
方法
1. 计算出能达到比活度的要求及足以使全部模板链完全合成所需的 [α-32P]dNTP 量,将其加入微量离心管中(参见本方案的概述)。
在反应的任一阶段,dNTP 的浓度都不能低于 1umol/L 为保持反应底物的髙浓度,应在尽量可能小的体积中进行廷伸反应。
2. 在离心管中加入适量的寡核苷酸引物和模板寡核苷酸。
为确保有效的放射性标记,反应液中引物的浓度应 3~10 倍摩尔过量于模板 DNA。
3. 加入 0.1 体积的 10X Klenow 缓冲液,充分混匀。
4. 按每 5ul 反应体积 2~4 单位加入 Klenow 片段,充分混勻。14°C 下温育反应 2~3 h。
如有必要,反应过程中可取出小置(0.1ul) 样品,测定可被 10% 三氯乙酸(TCA) 沉淀的放射性的比例来监测反应的进程(参见附录 8)。
5. 用等体积甲酰胺加样缓冲液稀释反应混合液,于 80°C 加热 3 分钟,然后将全部样品加至变性聚丙烯酰胺凝胶。
6. 电泳结束后,卸下电泳装置,将聚丙浠酰胺凝胶黏附于一侧的玻璃上(详细操作见第 12 章的方案 11)。
警惕:未掺入的 [α-32P]dNTP 可能迁移到下层电泳糟中,使其带有放射性。此时应将凝胶、玻璃板、缓冲液及电泳装置均作为放射源处理。应在聚异丁烯酸树脂防护屏后谨慎处理。
7. 将凝胶及其背面的玻璃板一起包裹于 Saran 包装膜内,记下指示染料的位置,用手提式小型探测仪检测凝胶上含寡核苷酸区域的放射性活度。在样品的边缘的包装膜上粘貼一组放射性墨水或磷光圆点标签,并用 Scotch 胶带覆盖放射性标签,以防放射性墨水污染胶片夹或增感屏。
8. 将凝胶在放射自显影胶片上曝光(见附录 9)。
通常掺入探针的放射性活度甚高,获得胶片图像的时间仅需数秒。
9. 胶片显影后,将放射性墨水的影像和放射性标签重叠,以定位探针在凝胶上的位置。切下条带,按第 5 章的方案 12 所述方法回收放射性标记的寡核苷酸。
溶液和缓冲液
稀样贮存液至适当浓度。
甲酰胺加样缓冲液
10XKlenow 缓冲液
酶与缓冲液
大肠杆菌 DNA 聚合酶 IKlenow 片段
凝胶
变性聚丙烯酰胺凝胶
丙烯酰胺在凝胶溶液中的比例及电泳条件,依反应混合液中寡核苷酸的大小不同而异,表 10-4 列出一些有用的提示:

聚丙烯酰胺凝胶通常用 lxTBE(89 mmol/LTris-硼酸,2 mmol/LEDTA) 灌制。电泳亦在此缓冲液中进行。聚丙烯酰胺凝胶灌制的方法与操作详见方案 1 及第十二章的方案 8。
核酸和寡核苷酸
寡核苷酸引物
用方案 1 所述方法纯化引物。为确保有效地标记,反应液中引物浓度应 3~10 倍摩尔过量于 DNA 模板。
寡核苷酸模板
用方案 1 所述方法纯化寡核苷酸模板。寡核苷酸模板的序列应与所需的放射性标记探针的序列互补。
放射性化合物
[α-32P]dNTP
为保持反应底物的高浓度,应在尽可能小的体积中进行链延伸反应因此,最好使用溶于乙醇-水中的放射性标记 dNTP, 而不是溶于缓冲的水溶液中。适量体积的醇溶 [α-32P]dNTP 可在即将用于标记反应的微量离心管中混合及挥发干燥。为最大限度减少前体化合物及探针的放射分解,尽可能在 [32P]dNTP 到达的当天进行探针的放射性标记。
专用设备
磷荧光粘贴标签(有商品供应)或极热级放射性墨水粘贴标签放射性墨水是由少量 32P 与防水黑色绘图墨水混合而成。在本方案中使用的墨水为“极热级”(手提式小型探测器计数大于 2000cps), 用一纤维尖笔将墨水点于粘貼标签上。应在纤维尖笔上贴上放射性物质专用标志胶带,妥善保管。化学发光标签可替代放射性墨水,可以从 Stratagene(Glogos) 公司购买。
这种标签可反复使用多次,但在下一次放射自显影前须用荧光照射。
预溫至 80°C 的水浴或模块。
附加试剂
本方案步骤 9 所需要的试剂列于第 5 章的方案 12。
方法
1. 计算出能达到比活度的要求及足以使全部模板链完全合成所需的 [α-32P]dNTP 量,将其加入微量离心管中(参见本方案的概述)。
在反应的任一阶段,dNTP 的浓度都不能低于 1umol/L 为保持反应底物的髙浓度,应在尽量可能小的体积中进行廷伸反应。
2. 在离心管中加入适量的寡核苷酸引物和模板寡核苷酸。
为确保有效的放射性标记,反应液中引物的浓度应 3~10 倍摩尔过量于模板 DNA。
3. 加入 0.1 体积的 10X Klenow 缓冲液,充分混匀。
4. 按每 5ul 反应体积 2~4 单位加入 Klenow 片段,充分混勻。14°C 下温育反应 2~3 h。
如有必要,反应过程中可取出小置(0.1ul) 样品,测定可被 10% 三氯乙酸(TCA) 沉淀的放射性的比例来监测反应的进程(参见附录 8)。
5. 用等体积甲酰胺加样缓冲液稀释反应混合液,于 80°C 加热 3 分钟,然后将全部样品加至变性聚丙烯酰胺凝胶。
6. 电泳结束后,卸下电泳装置,将聚丙浠酰胺凝胶黏附于一侧的玻璃上(详细操作见第 12 章的方案 11)。
警惕:未掺入的 [α-32P]dNTP 可能迁移到下层电泳糟中,使其带有放射性。此时应将凝胶、玻璃板、缓冲液及电泳装置均作为放射源处理。应在聚异丁烯酸树脂防护屏后谨慎处理。
7. 将凝胶及其背面的玻璃板一起包裹于 Saran 包装膜内,记下指示染料的位置,用手提式小型探测仪检测凝胶上含寡核苷酸区域的放射性活度。在样品的边缘的包装膜上粘貼一组放射性墨水或磷光圆点标签,并用 Scotch 胶带覆盖放射性标签,以防放射性墨水污染胶片夹或增感屏。
8. 将凝胶在放射自显影胶片上曝光(见附录 9)。
通常掺入探针的放射性活度甚高,获得胶片图像的时间仅需数秒。
9. 胶片显影后,将放射性墨水的影像和放射性标签重叠,以定位探针在凝胶上的位置。切下条带,按第 5 章的方案 12 所述方法回收放射性标记的寡核苷酸。




