用 Taq DNA 聚合酶进行双脱氧测序反应实验
材料与仪器去离子蒸馏水 ddNTP dNTP 甲酰胺加样缓冲液。酶和缓冲液。Taq 酶或类似的热稳定 DNA 聚合酶 Taq 酶稀释缓冲液 核酸和寡核苷酸 寡核
材料与仪器
去离子蒸馏水 ddNTP dNTP 甲酰胺加样缓冲液。酶和缓冲液。Taq 酶或类似的热稳定 DNA 聚合酶 Taq 酶稀释缓冲液 核酸和寡核苷酸 寡核苷酸引物 模板 DNA(100ug ul) 溶于 TE 中 放射性化合物 5'32P 标记的寡核苷酸引物
微量离心管(0.5 ml) 或微量滴定板 装有多孔加热板的程控热循环仪 可加热到 65°C 的水浴
微量离心管(0.5 ml) 或微量滴定板 装有多孔加热板的程控热循环仪 可加热到 65°C 的水浴
步骤
材料
缓冲液和溶液
试剂、缓冲液、储液的组成参见附录 1, 储液使用前稀释到适当浓度。
去离子蒸馏水(冰预冷)
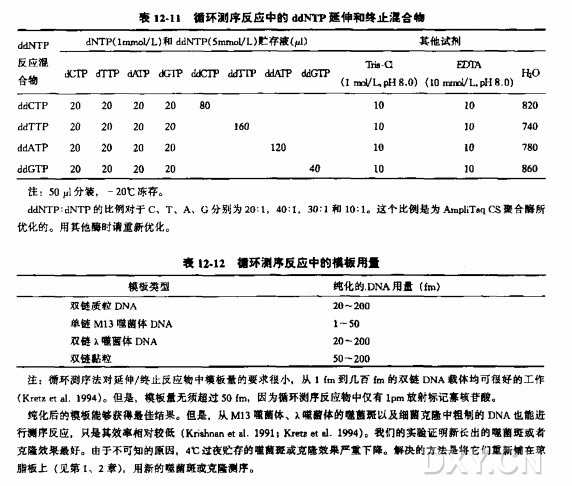
ddNTP,4 种 ddNTP 储液(5 mmoI/L)
dNTP,4 种 dNTP 储液(lmmol/L)
甲酰胺加样缓冲液
10x 标记混合液和 ddNTP 延伸/终止混合液
当测序模板富含二級结构时,用等摩尔 7-脱氨-2'-dGTP 代替 10X 标记混合液和 ddNTP 延伸/终止混合液中的 dGTP。
酶和缓冲液
5x 反应缓冲液
200 mmol/LTris-Cl(pH8.8)
25 mmol/LMgCl2
Taq 酶(5u/ul)或类似的热稳定 DNA 聚合酶
Taq 酶稀释缓冲液
25 mmol/LTris(pH8.8)
0.01 mmol/LEDTA(pH8.0)
0.15%Tween-20
0.15%NP-40
从其他生物体提取的热稳定酶的反应条件和反应缓冲液可能稍有不同。不同酶的最适缓冲液条件见制造商提供的使用说明书,单位热稳定 DMA 聚合酶的活性通常定义为:在 70~80°C,反应 30 min 将 10nmol 核苷酸转化为酸沉淀形式所需酶量为 1 个酶活性单位。
核酸和寡核苷酸
寡核苷酸引物
浓度为 1.0pmol/pl(约 6.6ng/ul), 溶于 TE(pH7.6) 中。
对于一些结合于靶区域上游载体序列的通用引物,可参见第 8 章信息栏“通用引物”及本章末尾信息栏“DNA 测序寡核苷酸引物储液制备”。
模板 DNA(100ug/ul) 溶于 TE(pH7.6) 中
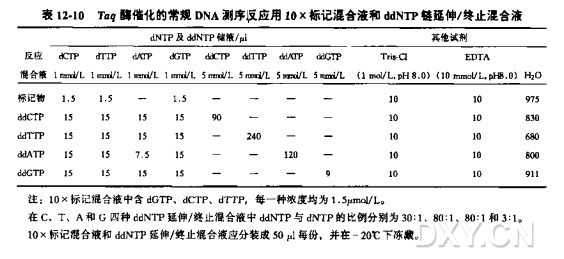
每一套测序反应需要 500ng 的单链 DNA 或 1.0ug 的变性双链质粒 DNA。变性双链线性 DNA, 并使它与引物复性。即先把天然模板 DNA 与过量的引物混合,在沸水浴中加热约 2 min, 然后把试管插入冰水浴中。不要让混合液温度回升,立刻使用。
小规模制备 M13 噬菌体重组于单链 DMA 的浓度一般在 0.05 到 0.5ug/ml 的范围内。这取决于特定噬菌体的生长速度。在正常的 Taq 酶催化的测序反应情况下,棋板 DMA 是过量的。因而每次测序反应中模板量上的微小变化并不影响测序结果的质量。可参见方案 4 的疑难解答。
放射性化合物
[a-32P]dATP(3000Ci/mmol,10mCi/ml) 或
[a-35S]dATP(1000Ci/mmol,10mCi/ml) 或
[a-33P]dATF(2000—4000Ci/mmol,~10mCi/ml) 或
5'32P 标记的寡核苷酸引物
若不用放射性标记 dATP 作为内标记,也可以用 5‘端以 32P 或 33P 标记的寡核苷酸引物进行测序反应。此时,可用 1.0~1.5pmol 放射性标记引物和 2ul 水代替反应中未标记引物和放射性标记 dATP(步骤 1), 其他步骤相同。一般用多核苷酸激酶催化 ATP 的 [γ-32P] 转移至寡核苷酸 5’末端。详细情况见第 10 章的方案 2。
专用设备
微量离心管(0.5 ml) 或微量滴定板(柔韧,耐热,每孔容量为 300ul 的 U 型孔 96 孔板)。
参见信息栏“微量滴定板”
装有多孔加热板的程控热循环仪(如 Dri-Blockcyclers,Techne 公司)。
其次可选用 45°C 和 72°C 的水浴。见第 8 步的说明,
可加热到 65°C 的水浴。
方法
1. 在 0.5 ml 微量离心管或微量滴定板孔中加入:
单链模板 DNA(250fmd)(100ng/ul) 5.0ul
寡核苷酸引物(0.5pmol)(约 3.3ng/ul) 3.0ul
5x 反应缓冲液 20.ul
2. 在 65°C 温育密封的微量离心管 2 min。从水浴中取出离心管,使之在 3~5 min 内冷却到室温。
有些实验人员喜欢用小加热板或装水的烧杯,使该退火反应在 30 min 的过程中缓慢却。我们实验中发现,这两种方法的实验结果相同。
3. 在引物和模板降温时,融化 10X 标记混合液、ddNTP 延伸/终止混合液和放射性标记的 dATP, 融化后置于冰上。
4. 在每一彩色标记的 0.5 ml 微量离心管或每一个提前标有 C、T、A 和 G 的微量滴定板孔中加入 4ul 与其相对应的 ddNTP 延伸/终止混合液(如标记为 C 的微量离心管和微量滴定板孔加入 4ul ddCTP 混合液,标记为 T 的微量离心管和微量滴定板孔加入 4ul ddTTP 混合等),并将微量离心管或微量滴定板置于冰上。
5. 按 1:8 比例稀释足够的热稳定 DNA 聚合酶用于所有模板测序,例如:
TaqDNA 聚合酶(5~101u/ul)
酶稀释缓冲液 7ul
每一组四种测序反应需要 2ul(2u) 稀释酶。酶终浓度应约为 lu/ul。稀释后的酶要一直放在冰上贮存。
6. 把下列物质加入到备退火反应管中(上述步骤 2):
10x 标记混合液 2ul
放射性标记 dATP 0.5ul
稀释的 DNA 聚合酶(约 1u/ul) 8ul
涡旋振荡混匀,然后在 45°C 温育反应 5 min。
7. 转移 4ul 标记反应液到含有相应的双脱氧终止混合液的 C、T、A、G 各管或微量滴定板各孔中(上述步骤 4), 沿微量离心管和微量滴定板孔壁加入。
8. 把小离心管放入微量离心机内(用合适的转头或适合 0.5 ml 离心管的衔接头,或把它们放入去盖的 1.5 ml 离心管中),或者把微量滴定板放入配有合适衔接头的离心机中,以 2000r/min 离心 C、T、A 和 G 各管或滴定板几秒钟,混合反应物。72°C 温育 5 min。
把小离心管或滴定板放在高效加热块中温育,也可以放在水、油或其他导热效率高的介质中。若放在 72°C 空气温箱中,在这样短的温育过程中达不到 TaqDNA 聚合酶所需的理想温度,
9. 加入 4ul 甲酰胺加样缓冲液终止反应。
10. 这些反应物在-20°C 时最多可保存 5 天,也可以用变性凝胶电泳直接分析(见方案 8、9 或 10、11 和 12)。热变性后(100°C,2 min),在冰上快速冷却。取 C、T、A 和 G 反应物各 3ul 加入测序凝胶的各孔中。
缓冲液和溶液
试剂、缓冲液、储液的组成参见附录 1, 储液使用前稀释到适当浓度。
去离子蒸馏水(冰预冷)
ddNTP,4 种 ddNTP 储液(5 mmoI/L)
dNTP,4 种 dNTP 储液(lmmol/L)
甲酰胺加样缓冲液
10x 标记混合液和 ddNTP 延伸/终止混合液
当测序模板富含二級结构时,用等摩尔 7-脱氨-2'-dGTP 代替 10X 标记混合液和 ddNTP 延伸/终止混合液中的 dGTP。
酶和缓冲液
5x 反应缓冲液
200 mmol/LTris-Cl(pH8.8)
25 mmol/LMgCl2
Taq 酶(5u/ul)或类似的热稳定 DNA 聚合酶
Taq 酶稀释缓冲液
25 mmol/LTris(pH8.8)
0.01 mmol/LEDTA(pH8.0)
0.15%Tween-20
0.15%NP-40
从其他生物体提取的热稳定酶的反应条件和反应缓冲液可能稍有不同。不同酶的最适缓冲液条件见制造商提供的使用说明书,单位热稳定 DMA 聚合酶的活性通常定义为:在 70~80°C,反应 30 min 将 10nmol 核苷酸转化为酸沉淀形式所需酶量为 1 个酶活性单位。
核酸和寡核苷酸
寡核苷酸引物
浓度为 1.0pmol/pl(约 6.6ng/ul), 溶于 TE(pH7.6) 中。
对于一些结合于靶区域上游载体序列的通用引物,可参见第 8 章信息栏“通用引物”及本章末尾信息栏“DNA 测序寡核苷酸引物储液制备”。

模板 DNA(100ug/ul) 溶于 TE(pH7.6) 中
每一套测序反应需要 500ng 的单链 DNA 或 1.0ug 的变性双链质粒 DNA。变性双链线性 DNA, 并使它与引物复性。即先把天然模板 DNA 与过量的引物混合,在沸水浴中加热约 2 min, 然后把试管插入冰水浴中。不要让混合液温度回升,立刻使用。
小规模制备 M13 噬菌体重组于单链 DMA 的浓度一般在 0.05 到 0.5ug/ml 的范围内。这取决于特定噬菌体的生长速度。在正常的 Taq 酶催化的测序反应情况下,棋板 DMA 是过量的。因而每次测序反应中模板量上的微小变化并不影响测序结果的质量。可参见方案 4 的疑难解答。
放射性化合物
[a-32P]dATP(3000Ci/mmol,10mCi/ml) 或
[a-35S]dATP(1000Ci/mmol,10mCi/ml) 或
[a-33P]dATF(2000—4000Ci/mmol,~10mCi/ml) 或
5'32P 标记的寡核苷酸引物
若不用放射性标记 dATP 作为内标记,也可以用 5‘端以 32P 或 33P 标记的寡核苷酸引物进行测序反应。此时,可用 1.0~1.5pmol 放射性标记引物和 2ul 水代替反应中未标记引物和放射性标记 dATP(步骤 1), 其他步骤相同。一般用多核苷酸激酶催化 ATP 的 [γ-32P] 转移至寡核苷酸 5’末端。详细情况见第 10 章的方案 2。
专用设备
微量离心管(0.5 ml) 或微量滴定板(柔韧,耐热,每孔容量为 300ul 的 U 型孔 96 孔板)。
参见信息栏“微量滴定板”
装有多孔加热板的程控热循环仪(如 Dri-Blockcyclers,Techne 公司)。
其次可选用 45°C 和 72°C 的水浴。见第 8 步的说明,
可加热到 65°C 的水浴。
方法
1. 在 0.5 ml 微量离心管或微量滴定板孔中加入:
单链模板 DNA(250fmd)(100ng/ul) 5.0ul
寡核苷酸引物(0.5pmol)(约 3.3ng/ul) 3.0ul
5x 反应缓冲液 20.ul
2. 在 65°C 温育密封的微量离心管 2 min。从水浴中取出离心管,使之在 3~5 min 内冷却到室温。
有些实验人员喜欢用小加热板或装水的烧杯,使该退火反应在 30 min 的过程中缓慢却。我们实验中发现,这两种方法的实验结果相同。
3. 在引物和模板降温时,融化 10X 标记混合液、ddNTP 延伸/终止混合液和放射性标记的 dATP, 融化后置于冰上。
4. 在每一彩色标记的 0.5 ml 微量离心管或每一个提前标有 C、T、A 和 G 的微量滴定板孔中加入 4ul 与其相对应的 ddNTP 延伸/终止混合液(如标记为 C 的微量离心管和微量滴定板孔加入 4ul ddCTP 混合液,标记为 T 的微量离心管和微量滴定板孔加入 4ul ddTTP 混合等),并将微量离心管或微量滴定板置于冰上。
5. 按 1:8 比例稀释足够的热稳定 DNA 聚合酶用于所有模板测序,例如:
TaqDNA 聚合酶(5~101u/ul)
酶稀释缓冲液 7ul
每一组四种测序反应需要 2ul(2u) 稀释酶。酶终浓度应约为 lu/ul。稀释后的酶要一直放在冰上贮存。
6. 把下列物质加入到备退火反应管中(上述步骤 2):
10x 标记混合液 2ul
放射性标记 dATP 0.5ul
稀释的 DNA 聚合酶(约 1u/ul) 8ul
涡旋振荡混匀,然后在 45°C 温育反应 5 min。
7. 转移 4ul 标记反应液到含有相应的双脱氧终止混合液的 C、T、A、G 各管或微量滴定板各孔中(上述步骤 4), 沿微量离心管和微量滴定板孔壁加入。
8. 把小离心管放入微量离心机内(用合适的转头或适合 0.5 ml 离心管的衔接头,或把它们放入去盖的 1.5 ml 离心管中),或者把微量滴定板放入配有合适衔接头的离心机中,以 2000r/min 离心 C、T、A 和 G 各管或滴定板几秒钟,混合反应物。72°C 温育 5 min。
把小离心管或滴定板放在高效加热块中温育,也可以放在水、油或其他导热效率高的介质中。若放在 72°C 空气温箱中,在这样短的温育过程中达不到 TaqDNA 聚合酶所需的理想温度,
9. 加入 4ul 甲酰胺加样缓冲液终止反应。
10. 这些反应物在-20°C 时最多可保存 5 天,也可以用变性凝胶电泳直接分析(见方案 8、9 或 10、11 和 12)。热变性后(100°C,2 min),在冰上快速冷却。取 C、T、A 和 G 反应物各 3ul 加入测序凝胶的各孔中。