植物组织中可溶性糖含量的测定
简介
可溶性糖多是带有甜味的一些糖,如葡萄糖、果糖、蔗糖、麦芽糖等。可溶性糖含 量是果实品质的一项重要指标,果实成熟过程中可溶性糖含量增加。可溶性糖也是植物细胞 渗透调节物质之一,干旱条件下植物组织中可溶性糖含量增加。测定可溶性糖含量可用于分 析果实品质,了解植物的生理状况。本实验目的在于掌握蔥酮比色法测定可溶性糖含量的原 理和方法。
原理
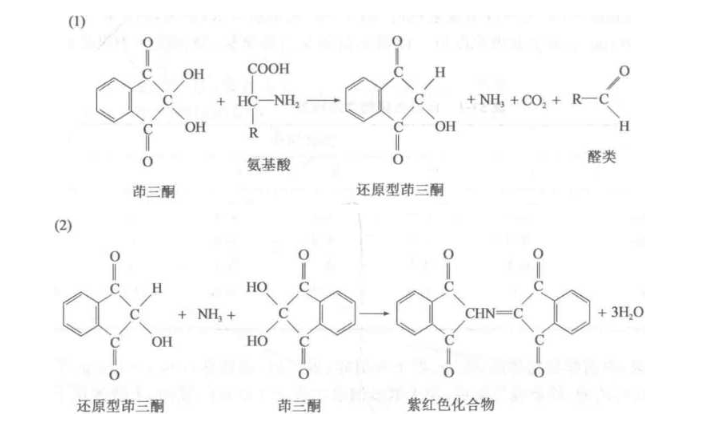
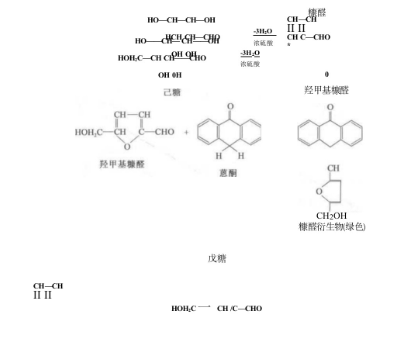
植物组织中可溶性糖含量的测定的基本原理是糖(sugar)在浓硫酸作用下,可经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛 或羟甲基糠醛与蔥酮脱水缩合,形成糠醛的衍生物,呈蓝绿色,其吸收峰为625 nmo在一定 范围内,颜色的深浅与糖的含量成正比, 故可用于糖的定量测定。
材料与仪器
材料:各种植物组织,如根、茎、叶、果实、种子等。
器材:分光光度计,天平,水浴锅,离心机或漏斗,具塞刻度试管,容量瓶,移液管等。
试剂:
①80% 乙醇
②100μg·mL-1标准葡萄糖溶液:准确称取烘干至恒重的葡萄糖 100 mg, 用 80% 乙醇溶解后定容至1 000 mL
③蔥酮试剂:称取蔥酮0.1 g溶于100 mL硫酸溶液(将76 mL相对密度为1.84的浓硫酸用蒸馅水稀释到100 mL), 贮于棕色瓶,当日配制使用。
步骤
植物组织中可溶性糖含量的测定的基本过程可分为如下几步:
1. 标准曲线的制作:取7支大试管,按表52-1添加试剂,立即摇匀,盖上盖子,在沸水浴中 煮沸10 min, 取出冷却至室温,用0管调零,在625 nm波长下比色。以标准葡萄糖含量作横 坐标,以吸光度值作纵坐标,绘制标准曲线。
表52-1标准曲线制作加样表
试剂 | 试管编号 | ||||||
0 | 1 | 2 | 3 | 4 | 5 | 6 | |
标准葡萄糖溶液/mL | 0 | 0.1 | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 |
蒸榴水/mL | 1.0 | 0.9 | 0.8 | 0.6 | 0.4 | 0.2 | 0 |
蔗糖浓度/(ptg・mL'1 ) | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
蔥酮试剂/mL | 5 | 5 | 5 | 5 | 5 | 5 | 5 |
2. 样品提取:将植物组织烘干、粉碎,准确称取50〜250 mg, 放入具塞刻度试管中,加 80% 乙醇10〜15 mL, 沸水浴提取30 min。离心后收集上清液,其残渣再加80% 乙醇10〜 15 mL重复提取2次,合并上清液。如是绿色组织,提取液需加少量活性炭于70笆下脱色、过 滤•定容至50 mL待测。如为鲜样,称取0.5-1 g, 加少许石英砂研磨成匀浆,连同残渣一起 用蒸馅水定容至100 mL, 室温下浸提30〜60 min, 其间经常摇动,离心或过滤,弃去残渣,测 前适当稀释。
3. 样品测定:吸取1 mL提取液于大试管中,加入5 mL蔥酮试剂,摇匀,用上述同样方 法,在625 nm处比色,记录吸光度值,从标准曲线上查出提取液中的可溶性糖含量。
4 . 结果计算:
可溶性糖含量=我貞><1。。%
式中:一从标准曲线上査得的蔗糖浓度,卩 g.mL-1 ;
V—样品总体积,mL;
W—样品重,mg。
注意事项
1. 提取可溶性糖所剩残渣放在 80°C 烘箱中烘干,可用于测定淀粉和纤维素。
2. 由于蔥酮试剂与糖反应的呈色强度随时间变化,故必须在反应后立即在同一时间比色。