一步法克隆
简介
一步法克隆是一种简单、快速和高效的克隆技术,现有许多一步法克隆试剂盒可以买到,它能够将扩增的 DNA 产物定向插入任何线性化载体的任何位点,线性化的载体和插入片段的 PCR 产物无需纯化即可直接用于重组,非常简便。
原理
一步法克隆需要引物设计时装配与载体相同的碱基序列,这样能够将扩增的 DNA 产物定向插入任何线性化载体的任何位点,利用同源重组,不需要 DNA 连接酶即可完成线性化载体和插入片段的重组。
用途
定点突变载体构建、片段截短载体构建。
材料与仪器
主要材料:
质粒(载体),PCR 模板、引物
高保真聚合酶(Hieff Canace Plus High-Fidelity DNA Polymerase,货号 10153ES60)
一步法克隆试剂盒(Hieff Clone® Plus One Step Cloning Kit 一步法快速克隆试剂盒,货号 10911ES20)
感受态细胞
如果是酶切制备线性化载体则还需要准备相应限制性内切酶,反向 PCR 扩增需要 DpnI 内切酶。
其他材料:
ddH2O、PCR 管、PCR 仪器
步骤
一、制备线性化载体:
方法一 限制性内切酶消化环状载体
单酶切所需消化时间长,消化较难完全,假阳性率高一些;双酶切假阳性率低一些,最后酶切产物需要加热,以降解限制性内切酶,方可直接用于重组反应。
方法二 PCR 扩增
使用 PCR 制备线性化载体时,需使用高保真酶进行扩增,以免扩增片段过长导致点突变。同样,PCR 产物需要用 DpnI 消化,以降解扩增模板,方可直接用于重组反应,这样可以减少假阳性。
对线性载体的评估:将线性化产物跑 DNA 凝胶,好的产物的条带单一且亮,而且没有拖尾和弥散,表示线性化完全,如果出现拖尾或者弥散,则表示酶切不完全或者酶切时间过长,需要调整酶切条件。
二、准备插入片段:
1. 引物设计:
酶切法引物设计:选一个或者两个酶切位点,自线性载体的酶切位点开始向 5’端选择15个左右碱基(加上酶切位点总共 21 个左右碱基),分别加在前引物和后引物的 5’端前面(注意 5’端与 3’端首尾相连);PCR 法引物设计:在上游引物的 5’端加入线性化位点 5’方向的 20 个 bp 的载体序列,在下游引物的 5’加入线性化位点 3’方向的 20 个 bp 的载体序列。使扩增的插入片段和线性化载体的末端具有相同序列的进行同源重组。
2. PCR 扩增插入片段:
PCR 扩增体系可根据所用 PCR 试剂盒说明书配置,选择平时用的程序即可。但是此过程最好使用高保真酶以减少扩增可能出现的碱基缺失或改变。产物需通过跑 DNA 凝胶进行评估,好的 PCR 产物条带应该是单一且亮的,如果出现非特异性杂带,那么应该跑 DNA 凝胶将条带分开,裁取我们需要位置的条带进行回收纯化;如果条带非常浅,则可以取少量 PCR 产物再次进行扩增。
三、重组:
将线性化的载体和插入片段按适当比例混合,用一步法克隆试剂盒说明书指导下孵育进行重组反应。以Hieff Clone® Plus One Step Cloning Kit 一步法快速克隆试剂盒 10911ES20 为例。
1. 线性化载体与插入片段的使用量计算
最适载体与插入片段摩尔比为 1:2-1:3,即最适插入片段使用量为 0.06~0.09 pmol。可由以下公式粗略计算获得:
最适载体使用量 = [0.02 × 载体碱基对数] ng (0.03 pmol)
最适插入片段使用量 = [0.04 × 插入片段碱基对数] ng (0.06 pmol) 或 = [0.06 × 插入片段碱基对数] ng (0.09 pmol)
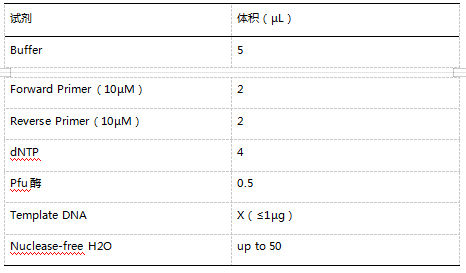
2. 重组反应体系

3. 重组反应条件:体系配置完成后,轻轻吹打混匀,50 ℃ 20 min。待反应完成后,冰上冷却 5 min,进行转化或 -20 ℃ 保存。
四、转化:
重组产物可直接用于转化。
五、验证:
菌落可摇菌送测序或者进行菌落 PCR + 电泳。
注意事项
1. 引物 GC 含量:GC 含量一般在 40~60% 之间,过高或者过低都不利于反应。
常见问题
1. 测序结果发现重组载体中没有插入片段:可能是因为 PCR 体系出错导致没有扩增,此时可以跑 DNA 凝胶查看是否有扩增条带。
2. 菌落 PCR 电泳无条带:可能是引物设计不对,此时最好将引物和载体共同测序,查看是否有同源序列;也可能是因为载体线性化不完全导致重组失败,此时需要优化酶消化系统。