双脱氧链终止法测序用变性模板的制备实验
材料与仪器乙酸铵 氯仿 异戊醇 DMSO 乙醇 NaOH酚 测序反应缓冲液 琼脂糖凝胶 寡核苷酸引物 闭环双链质粒 DNA干冰-乙醇浴 65C 水浴步骤材料缓冲
材料与仪器
乙酸铵 氯仿 异戊醇 DMSO 乙醇 NaOH酚 测序反应缓冲液 琼脂糖凝胶 寡核苷酸引物 闭环双链质粒 DNA
干冰-乙醇浴 65°C 水浴
干冰-乙醇浴 65°C 水浴
步骤
材料
缓冲液和溶液
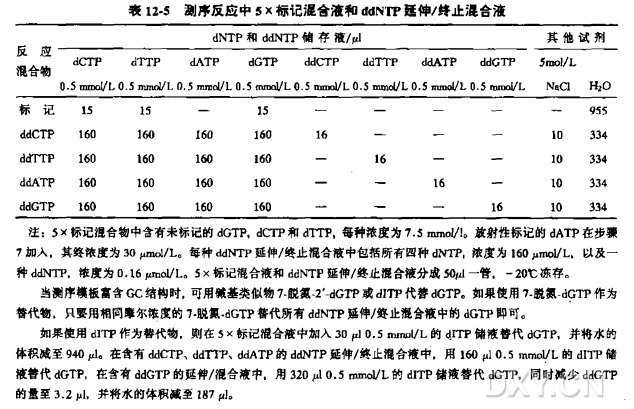
试剂、缓冲液、储液的组成参见附录 1, 储液使用前稀释到适当浓度。
乙酸铵(5mol/L, 非缓冲,pH~7.4)
氯仿:异戊醇(24:1,V/V)
DMSO
可选用,请参见步骤 10。
乙醇
NaOH(2mol/L)/EDTA(2 mmol/L)
使用前将 10mol/L 氢氧化钠储液稀释到合适浓度。
酚,用水或 TE(pH7.6) 平衡。
测序反应缓冲液
凝胶
琼脂糖凝胶(0.8% m/V)
核酸和寡梭苷酸
寡核苷酸引物
变性双链 DNA 模板测序所用寡核苷酸引物一般比单链 DNA 模板测序所用引物要长 20~30 个核苷酸。
变性双链 DNA 模板测序使用长引物可以减少假带的出现。
结合靶区域上游载体序列的通用引物表见第 8 章信息栏“通用引物”,并参阅本章信息栏“DNA 测序引物储液配制”。
闭环双链质粒 DNA
从培养菌体中小规模或大规模制备质粒 DNA 方法见第 1 章,也可以按照本方案后面的备选方法进行。
四组一套的测序反应(ddA,ddG、ddC、ddT) 需要 5ug DNA。
专用设备
干冰-乙醇浴
65°C 水浴
方法
1. 取 5ug 纯化质粒 DNA 加至 1.5 ml 微量离心管中,补加水至总体积为 50ul。加入10ul 新配制的 2mol/LNaOH/2 mmol/LEDTA 溶液,室温放置 5 min。
2. 加入 30ul 5mol/L 乙酸铵,涡旋振荡混匀。
3. 加入 45ul 平衡酚,涡旋振荡混匀。
4. 加人 135 氯仿: 异戊醇,涡旋振荡混匀。然后在室温下用微量离心机以最大转速离心 15 min。
5. 小心吸取上层水相至一干净微量离心管中,加入 330ul 冰预冷乙醇,混匀。置于干冰-乙醇浴中,放置 15 min。
6. 在下用微量离心机以最大转速离心 15 min, 回收变性 DNA。
7. 仔细倾去上清液,不要搅动 DNA 沉淀,DNA 沉淀在管壁上可能看得见,也可能看不见。
8. 重新离心 2S,用 Tip 头将残存的痕量乙醇吸干净,不要搅动 DNA 沉淀。
9. 在室温下凉干 DNA 沉淀,然后用蒸馏水重新溶解 DNA, 使其终浓度为 lug/ul。
10. 退火使引物 DNA 与变性模板结合,对于四组一套的 DNA 测序反应使用 5ug(5ul)碱变性质粒 DNA(如在含有 ddA 的反应中,变性 DNA 的量为 1.25ug; 在含有ddG 的反应中,变性 DNA 的量为 1.25ug; 依此类推)。设立退火反应如下:
碱变性 DNA 5.0ug(溶于 5ul 水中)
DMSO~undefined可选) 2.0ul
测序蘼反应缓冲液 2.0ul
测序引物 10.ul(10ug)
水 至终体积 11.0ul
~undefined请参见方案 4 的疑难解答。
加热混合物至 65°C,2 min。然后使之缓慢冷却至室温。将退火的样品保存于冰上,直至进行延伸/链终止反应。
11. 接着按方案 3 的步骤 3 进行。

缓冲液和溶液
试剂、缓冲液、储液的组成参见附录 1, 储液使用前稀释到适当浓度。
乙酸铵(5mol/L, 非缓冲,pH~7.4)
氯仿:异戊醇(24:1,V/V)
DMSO
可选用,请参见步骤 10。
乙醇
NaOH(2mol/L)/EDTA(2 mmol/L)
使用前将 10mol/L 氢氧化钠储液稀释到合适浓度。
酚,用水或 TE(pH7.6) 平衡。
测序反应缓冲液
凝胶
琼脂糖凝胶(0.8% m/V)
核酸和寡梭苷酸
寡核苷酸引物
变性双链 DNA 模板测序所用寡核苷酸引物一般比单链 DNA 模板测序所用引物要长 20~30 个核苷酸。
变性双链 DNA 模板测序使用长引物可以减少假带的出现。
结合靶区域上游载体序列的通用引物表见第 8 章信息栏“通用引物”,并参阅本章信息栏“DNA 测序引物储液配制”。
闭环双链质粒 DNA
从培养菌体中小规模或大规模制备质粒 DNA 方法见第 1 章,也可以按照本方案后面的备选方法进行。
四组一套的测序反应(ddA,ddG、ddC、ddT) 需要 5ug DNA。
专用设备
干冰-乙醇浴
65°C 水浴
方法
1. 取 5ug 纯化质粒 DNA 加至 1.5 ml 微量离心管中,补加水至总体积为 50ul。加入10ul 新配制的 2mol/LNaOH/2 mmol/LEDTA 溶液,室温放置 5 min。
2. 加入 30ul 5mol/L 乙酸铵,涡旋振荡混匀。
3. 加入 45ul 平衡酚,涡旋振荡混匀。
4. 加人 135 氯仿: 异戊醇,涡旋振荡混匀。然后在室温下用微量离心机以最大转速离心 15 min。
5. 小心吸取上层水相至一干净微量离心管中,加入 330ul 冰预冷乙醇,混匀。置于干冰-乙醇浴中,放置 15 min。
6. 在下用微量离心机以最大转速离心 15 min, 回收变性 DNA。
7. 仔细倾去上清液,不要搅动 DNA 沉淀,DNA 沉淀在管壁上可能看得见,也可能看不见。
8. 重新离心 2S,用 Tip 头将残存的痕量乙醇吸干净,不要搅动 DNA 沉淀。
9. 在室温下凉干 DNA 沉淀,然后用蒸馏水重新溶解 DNA, 使其终浓度为 lug/ul。
10. 退火使引物 DNA 与变性模板结合,对于四组一套的 DNA 测序反应使用 5ug(5ul)碱变性质粒 DNA(如在含有 ddA 的反应中,变性 DNA 的量为 1.25ug; 在含有ddG 的反应中,变性 DNA 的量为 1.25ug; 依此类推)。设立退火反应如下:
碱变性 DNA 5.0ug(溶于 5ul 水中)
DMSO~undefined可选) 2.0ul
测序蘼反应缓冲液 2.0ul
测序引物 10.ul(10ug)
水 至终体积 11.0ul
~undefined请参见方案 4 的疑难解答。
加热混合物至 65°C,2 min。然后使之缓慢冷却至室温。将退火的样品保存于冰上,直至进行延伸/链终止反应。
11. 接着按方案 3 的步骤 3 进行。