连续梯度法(氯化铯-溴化乙锭梯度平衡离心法纯化闭环 DNA 实验)
原理用含氯化铯和溴化乙锭的悬浮密度梯度离心法分离质粒和染色体 DNA 的方法,取决于与线状 DNA 和闭环 DNA 结合的溴化乙锭的量的差异。材料与仪器粗制质粒
原理
用含氯化铯和溴化乙锭的悬浮密度梯度离心法分离质粒和染色体 DNA 的方法,取决于与线状 DNA 和闭环 DNA 结合的溴化乙锭的量的差异。
材料与仪器
粗制质粒
CsCl CsCl 再分带溶液 乙醇 溴化乙锭 石蜡油
皮下注射针头 折光仪 一次性注射器
CsCl CsCl 再分带溶液 乙醇 溴化乙锭 石蜡油
皮下注射针头 折光仪 一次性注射器
步骤
一、材料
1. 缓冲液和溶液
CsCl ( 固体),CsCl 再分带溶液,乙醇,溴化乙锭 ( 10 mg/ml ),石蜡油
2. 核酸和寡核苷酸
粗制质粒
3. 离心机和转头
Sorvall SS-34 转头或相当的转头,超速离心机转头(最好为垂直式)和离心管
(如果离心时间不是限制因素,可用 Beckman Vti65、角度转头 Ti50、Ti65、Ti70 或 Sorvall 的相当产品。使用可快封的 polyallomer 管或相当产品。)
4. 专用设备
皮下注射针头(21 号),巴斯德吸管或配大口径针头的一次性注射器,折光仪(可选),带有 18 号皮下注射针头的一次性注射器(5~10 ml, 无菌)
(尽管并非必需,折光仪在估计 CsCl 溶液密度时十分有用。)
二、方法
1. 测定粗制质粒 DNA 的量。最好通过向一个已在天平上调零的洁净管中加入溶液来测定,每克质粒 DNA 溶液中准确加入 1.01 g 固体 CsCl,闭上管盖以防蒸发,于 30℃ 温育促使 CsCl 溶解。轻轻混合溶液直到 CsCl 溶解。
每个梯度的 DNA 用量宜来自不超过 50 ml 过夜培养物的粗制质粒。因为 Beckman VT65.2 转子的垂直离心管只可容纳约 5 ml CsCl-溴化乙锭溶液,所以来自 50 ml 培养物的粗制质粒 DNA 应重溶于约 3 ml TE ( pH 8.0 ) 中。
2. 向每 5 g DNA 原液中加入 100 μl 10 mg/ml 的溴化乙锭溶液。
溶液的终密度应约为 1.55 g/ml(折射率为 1.3860 ),溴化乙锭的浓度约为 200 μg/ml。以往曾认为,欲使溴化乙锭与闭环 DNA 和线状 DNA 的结合达饱和,大剂量的溴化乙锭是必需的,所以溴化乙锭的用量要大得多 ( Radloff et al. 1967)。然而,由于高浓度未结合的溴化乙锭可能会使微弱的 DNA 区带模糊不清以致在紫外线下才能看见。因而近年来成功使用低浓度的溴化乙锭,使得 DNA 区带在可见光下显现。不过,当含有低浓度溴化乙锭的梯度载有过量核酸时,又会出现问题:在这种情况下,可能没有足够的溴化乙锭与闭环 DNA 和线状 DNA 达饱和结合。因为在 CsCl-溴化乙锭梯度中大多数溴化乙锭不是与 DNA 而是与存在于粗制质粒 DNA 中的细菌 RNA 结合,所以在超速离心之前用不含 DNA 酶的 RNA 酶处理粗制品,此问题可予解决。如果来自 50 ml DNA 细菌培养物的粗制质粒 DNA 用 3 ml TE ( pH 8.0) 重溶,再用来制备一个 5 ml CsCl-溴化乙锭梯度,则该处理通常不是必需的。
3. 如果使用 Corex 玻璃管,将溶液于室温用 7700 g ( 8000 r/min,Sorvall SS-34 转子)离心 5 min;如果使用一次性聚丙烯管,则用 1100 g (3000 r/min,Sorvall SS-34 转子)离心 10 min。
浮在离心管顶部的暗红色渣滓是溴化乙锭和细菌蛋白形成的复合物,离心管底部的沉淀是宿主菌被 SDS 和(或)热裂解而产生的碎片。当宿主菌被 SDS 或煮沸裂解是常会遇到棘手的问题,而用碱裂解产生的碎片较少。
4. 用巴斯德吸管或带大号针头的一次性注射器将浮渣之下、沉淀之上的清亮红色溶液转移到适用于超速离心转子的离心管中,用轻石蜡油或重新分层溶液加满该离心管。离心时确保转子中离心管重量的平衡。按照厂家说明密封离心管。
注意给转子中 DNA 样品编号。
5. 用适当的转子于 20℃ 进行密度梯度离心:
Beckman NVT65 转子 366000 g ( 62000 r/min) 6 h;
Beckman VTi65 转子 194000 g ( 45000 r/rnin ) 16 h;
Beckman Type 50Ti转子 180000 g ( 45000 r/min ) 48 h;
Beckman Type 65Ti 转子 314000 g ( 60000 r/min ) 24 h;
Beckinan Type 70.1 Ti 转子 331000 g(60000 r/min)24 h。
6. 离心结束后,从离心机上轻轻取下转子水平放置。小心取出每个离心管,放于覆有锡箔的试管架上。在仅有微光的室内(即关闭头顶的日光灯),将离心管放在铁架台的铁箍上。
在普通光照下,于梯带中心可见两条 DNA 区带。上层区带的内含物通常较少,由线状的细菌 ( 染色体)DNA 和带切口的环状质粒 DNA 组成;下层区带则由闭环质粒 DNA 组成。管底的深红色沉淀是溴化乙锭与 RNA 的复合物,位于 CaCl 溶液和石蜡油之间的物质是蛋白质。
如果质粒 DNA 产量较低,可用手提式长波紫外灯检测离心后的 DNA,可将其与含有分离好的 DNA 的离心管装在同一铁架台的铁箍上。紫外线照射在离心管上可使溴化乙锭和 DNA 的复合场发出明亮的橘红色荧光,有助于用针头或注射器将其吸去。如使用紫外灯,因为质粒 DNA 过度暴露于紫外线下会遭破坏,故应尽快收获质粒 DNA。此外,应戴上面罩以防眼睛受到紫外线伤害。虽然长波紫外线照射引起的伤害较短波小,但依然能够损伤眼睛。
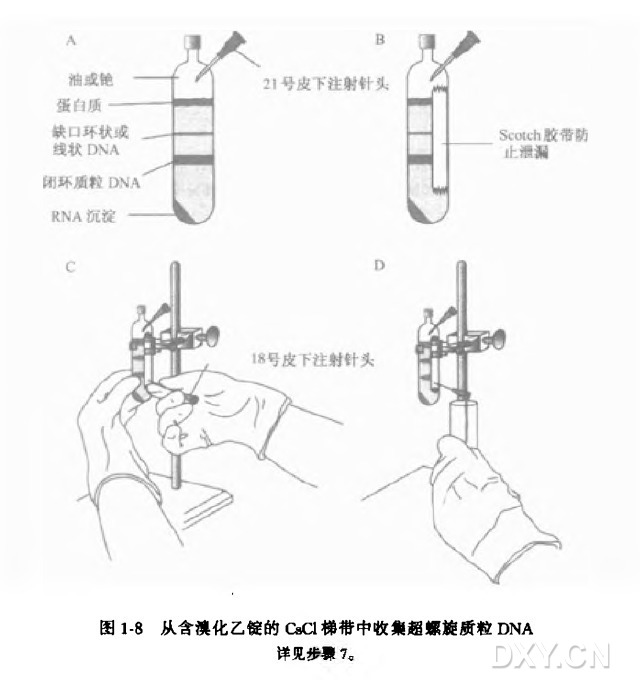
7. 收集闭环 DNA 区带。
(1) 用 21 号皮下注射针头在离心管顶端扎一个小孔以使液体被吸出时空气能进入。
(2) 用乙醇小心擦拭离心管外壁以除去任何油脂,然后用一块 Scotch 胶带或 Time 胶带贴于管外壁。
胶带起密封作用以减少针头穿刺后的泄漏。
(3) 将一个 5~10 ml 的一次性注射器装上一个无菌的 18 号皮下注射针头,将针头斜面向上地穿过胶带插入管中,以使针头的斜面开口正好位于较低的 DNA 区带 ( 闭环质粒 DNA ) 的下方。
(4) 缓慢吸出质粒 DNA,小心不要搅动上方黏稠的染色体 DNA 区带。
欲避免染色体 DNA 的污染,不要试图从梯带中移去毎一点可见的痕量闭环质粒 DNA。
有些研究者喜欢在移去较低的闭环质粒 DNA 区带之前先去除较上方的 DNA 区带。此法不太可取,这是因为位于较上层的黏稠的高分子质量染色体 DNA 能缠绕住闭环质粒 DNA 并将其带出离心管。
8. 从 DNA 中去除溴化乙锭。
为了减少闭环 DNA 区带中染色体 DNA 和 RNA 片段的污染,有些固执着将闭环 DNA 重新分层。欲使质粒 DNA 重新分层,应将注射器中的内含物缓慢转移至一个新的可快速密封的 polyallomer 离心管中,再装满 CsCl 重分区带溶液。密封离心管,再次离心,用如上所述步骤 5~7 回收闭环质粒 DNA。
1. 缓冲液和溶液
CsCl ( 固体),CsCl 再分带溶液,乙醇,溴化乙锭 ( 10 mg/ml ),石蜡油
2. 核酸和寡核苷酸
粗制质粒
3. 离心机和转头
Sorvall SS-34 转头或相当的转头,超速离心机转头(最好为垂直式)和离心管
(如果离心时间不是限制因素,可用 Beckman Vti65、角度转头 Ti50、Ti65、Ti70 或 Sorvall 的相当产品。使用可快封的 polyallomer 管或相当产品。)
4. 专用设备
皮下注射针头(21 号),巴斯德吸管或配大口径针头的一次性注射器,折光仪(可选),带有 18 号皮下注射针头的一次性注射器(5~10 ml, 无菌)
(尽管并非必需,折光仪在估计 CsCl 溶液密度时十分有用。)
二、方法
1. 测定粗制质粒 DNA 的量。最好通过向一个已在天平上调零的洁净管中加入溶液来测定,每克质粒 DNA 溶液中准确加入 1.01 g 固体 CsCl,闭上管盖以防蒸发,于 30℃ 温育促使 CsCl 溶解。轻轻混合溶液直到 CsCl 溶解。
每个梯度的 DNA 用量宜来自不超过 50 ml 过夜培养物的粗制质粒。因为 Beckman VT65.2 转子的垂直离心管只可容纳约 5 ml CsCl-溴化乙锭溶液,所以来自 50 ml 培养物的粗制质粒 DNA 应重溶于约 3 ml TE ( pH 8.0 ) 中。
2. 向每 5 g DNA 原液中加入 100 μl 10 mg/ml 的溴化乙锭溶液。
溶液的终密度应约为 1.55 g/ml(折射率为 1.3860 ),溴化乙锭的浓度约为 200 μg/ml。以往曾认为,欲使溴化乙锭与闭环 DNA 和线状 DNA 的结合达饱和,大剂量的溴化乙锭是必需的,所以溴化乙锭的用量要大得多 ( Radloff et al. 1967)。然而,由于高浓度未结合的溴化乙锭可能会使微弱的 DNA 区带模糊不清以致在紫外线下才能看见。因而近年来成功使用低浓度的溴化乙锭,使得 DNA 区带在可见光下显现。不过,当含有低浓度溴化乙锭的梯度载有过量核酸时,又会出现问题:在这种情况下,可能没有足够的溴化乙锭与闭环 DNA 和线状 DNA 达饱和结合。因为在 CsCl-溴化乙锭梯度中大多数溴化乙锭不是与 DNA 而是与存在于粗制质粒 DNA 中的细菌 RNA 结合,所以在超速离心之前用不含 DNA 酶的 RNA 酶处理粗制品,此问题可予解决。如果来自 50 ml DNA 细菌培养物的粗制质粒 DNA 用 3 ml TE ( pH 8.0) 重溶,再用来制备一个 5 ml CsCl-溴化乙锭梯度,则该处理通常不是必需的。
3. 如果使用 Corex 玻璃管,将溶液于室温用 7700 g ( 8000 r/min,Sorvall SS-34 转子)离心 5 min;如果使用一次性聚丙烯管,则用 1100 g (3000 r/min,Sorvall SS-34 转子)离心 10 min。
浮在离心管顶部的暗红色渣滓是溴化乙锭和细菌蛋白形成的复合物,离心管底部的沉淀是宿主菌被 SDS 和(或)热裂解而产生的碎片。当宿主菌被 SDS 或煮沸裂解是常会遇到棘手的问题,而用碱裂解产生的碎片较少。
4. 用巴斯德吸管或带大号针头的一次性注射器将浮渣之下、沉淀之上的清亮红色溶液转移到适用于超速离心转子的离心管中,用轻石蜡油或重新分层溶液加满该离心管。离心时确保转子中离心管重量的平衡。按照厂家说明密封离心管。
注意给转子中 DNA 样品编号。
5. 用适当的转子于 20℃ 进行密度梯度离心:
Beckman NVT65 转子 366000 g ( 62000 r/min) 6 h;
Beckman VTi65 转子 194000 g ( 45000 r/rnin ) 16 h;
Beckman Type 50Ti转子 180000 g ( 45000 r/min ) 48 h;
Beckman Type 65Ti 转子 314000 g ( 60000 r/min ) 24 h;
Beckinan Type 70.1 Ti 转子 331000 g(60000 r/min)24 h。
6. 离心结束后,从离心机上轻轻取下转子水平放置。小心取出每个离心管,放于覆有锡箔的试管架上。在仅有微光的室内(即关闭头顶的日光灯),将离心管放在铁架台的铁箍上。
在普通光照下,于梯带中心可见两条 DNA 区带。上层区带的内含物通常较少,由线状的细菌 ( 染色体)DNA 和带切口的环状质粒 DNA 组成;下层区带则由闭环质粒 DNA 组成。管底的深红色沉淀是溴化乙锭与 RNA 的复合物,位于 CaCl 溶液和石蜡油之间的物质是蛋白质。
如果质粒 DNA 产量较低,可用手提式长波紫外灯检测离心后的 DNA,可将其与含有分离好的 DNA 的离心管装在同一铁架台的铁箍上。紫外线照射在离心管上可使溴化乙锭和 DNA 的复合场发出明亮的橘红色荧光,有助于用针头或注射器将其吸去。如使用紫外灯,因为质粒 DNA 过度暴露于紫外线下会遭破坏,故应尽快收获质粒 DNA。此外,应戴上面罩以防眼睛受到紫外线伤害。虽然长波紫外线照射引起的伤害较短波小,但依然能够损伤眼睛。
7. 收集闭环 DNA 区带。
(1) 用 21 号皮下注射针头在离心管顶端扎一个小孔以使液体被吸出时空气能进入。
(2) 用乙醇小心擦拭离心管外壁以除去任何油脂,然后用一块 Scotch 胶带或 Time 胶带贴于管外壁。
胶带起密封作用以减少针头穿刺后的泄漏。
(3) 将一个 5~10 ml 的一次性注射器装上一个无菌的 18 号皮下注射针头,将针头斜面向上地穿过胶带插入管中,以使针头的斜面开口正好位于较低的 DNA 区带 ( 闭环质粒 DNA ) 的下方。
(4) 缓慢吸出质粒 DNA,小心不要搅动上方黏稠的染色体 DNA 区带。
欲避免染色体 DNA 的污染,不要试图从梯带中移去毎一点可见的痕量闭环质粒 DNA。
有些研究者喜欢在移去较低的闭环质粒 DNA 区带之前先去除较上方的 DNA 区带。此法不太可取,这是因为位于较上层的黏稠的高分子质量染色体 DNA 能缠绕住闭环质粒 DNA 并将其带出离心管。

8. 从 DNA 中去除溴化乙锭。
为了减少闭环 DNA 区带中染色体 DNA 和 RNA 片段的污染,有些固执着将闭环 DNA 重新分层。欲使质粒 DNA 重新分层,应将注射器中的内含物缓慢转移至一个新的可快速密封的 polyallomer 离心管中,再装满 CsCl 重分区带溶液。密封离心管,再次离心,用如上所述步骤 5~7 回收闭环质粒 DNA。





