细胞提取物中β-半乳糖苷酶的测定实验
材料与仪器转染了感兴趣 DNA 的哺乳动物培养细胞大肠杆菌β-半乳糖苷酶 Tris-Cl 磷酸钠 ONPG Na2CO3 β-巯基乙醇 MgCl2步骤材料缓冲液
材料与仪器
转染了感兴趣 DNA 的哺乳动物培养细胞
大肠杆菌β-半乳糖苷酶 Tris-Cl 磷酸钠 ONPG Na2CO3 β-巯基乙醇 MgCl2
大肠杆菌β-半乳糖苷酶 Tris-Cl 磷酸钠 ONPG Na2CO3 β-巯基乙醇 MgCl2
步骤
材料
缓冲液和溶液
贮存液稀释到适当浓度。
100XMgCl2
0.1mol/L MgCl2
4.5mo1/L β-巯基乙醇
临用前,加入适量的 14.7mol/Lβ-巯基乙醇贮存液。
Na2CO3(1mol/L)
10.6 g 无水固体溶于 100 ml 水中。
1xONPG
ONPG 溶于 0.1mol/L 磷酸钠(pH7.5) 中,浓度为 4 mg/ml。
磷酸钠(0.1mol/L,pH7.5)
混合 41 ml 0.2mol/L Na2HPO4•2H2O(Mt=178.05;35.61 g/L),9 ml 0.2mol/L NaH2PO4•2H2O(Mr=156.01;31.21 g/L) 和 50 ml 水。
Tris-Cl(1mol/L,pH7.8)
酶和缓冲液
大肠杆菌β-半乳糖苷酶
该酶是商品化的(如 Sigma 公司)
附加试剂
本方案步骤 1 需要列在本章方案 5 中的试剂。
细胞和组织
转染了感兴趣 DNA 的哺乳动物培养细胞
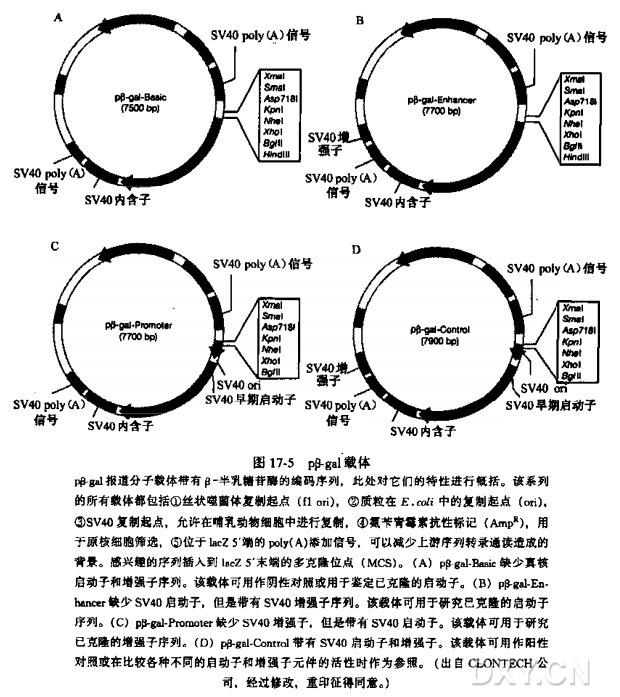
使用第 16 章的某种转染方案,用带有半乳糖苷酶报道基因的质粒(如 CLONTECH 公司的报道分子系列载体;请见图 17-5) 转染细胞。

方法
1. 如方案 5 步骤 1~4 所述,用转染的细胞制备细胞抽提物。取约 30ul 抽提物测定β-半乳糖苷酶。所需抽提物的确切数量要根据驱动β-半乳糖苷酶基因表达的启动子的强度、转染效率和测定时的孵育时间来确定。如果要用热处理灭活内源性β-半乳糖苷酶,测定前把细胞裂解物在 50°C 孵育 45~60 min。预热处理也会使荧光素酶失活,所以如果使用预热处理,荧光素酶和β-半乳糖苷酶活性测定要分开用不同一份细胞裂解物进行。
2. 对于每个用于测定的转染细胞裂解物样品,混合:
100xMg2+溶液 3ul
1xONPG 66ul
细胞抽提物 30ul
0.1mol/L 磷酸钠(PH7.5) 201ul
阴性和阳性对照都是必需的,它们分别检査内源性抑制剂和β-半乳糖苷酶是否存在。所有对照实验应该含有 30ul 假转染细胞的裂解物。此外,阳性对照应该包括 1ul 商品化的大肠杆菌β-半乳糖苷酶制品<50 单位/ml。商品化的酶制品应该溶在 0.1mol/L 磷酸钠(PH7.5) 中,浓度为 3000 单位/ml。临用前,把 1ul β—半乳糖苷酶贮存液加到 60ul 0.1mol/L 磷酸钠(PH7.5) 中配成 50 单位/ml 的酶工作液。每单位大肠杆菌半乳糖苷酶定义为在 37°C,1 min 内水解 1umol ONPG 底物的酶量。
3. 反应液在 37°C 孵育 30 min 或者直到淡黄色出现。大多数细胞类型中,内源性β-半乳糖苷酶的背景非常低,允许孵育时间长到 4~6 h。
4. 每个管子加入 500ul 1mol/L Na2CO3 使反应终止。在分光光度计上读 420nm 波长的光密度值。
测量的线性范围是 0.2~0.8OD420。如果测量值在线性范围外, 用少一些蛋白抽提物进行重复实验。抽提物可以用 0.25mol/L Tris-Cl(pH7.8) 稀释以减低蛋白浓度。

缓冲液和溶液
贮存液稀释到适当浓度。
100XMgCl2
0.1mol/L MgCl2
4.5mo1/L β-巯基乙醇
临用前,加入适量的 14.7mol/Lβ-巯基乙醇贮存液。
Na2CO3(1mol/L)
10.6 g 无水固体溶于 100 ml 水中。
1xONPG
ONPG 溶于 0.1mol/L 磷酸钠(pH7.5) 中,浓度为 4 mg/ml。
磷酸钠(0.1mol/L,pH7.5)
混合 41 ml 0.2mol/L Na2HPO4•2H2O(Mt=178.05;35.61 g/L),9 ml 0.2mol/L NaH2PO4•2H2O(Mr=156.01;31.21 g/L) 和 50 ml 水。
Tris-Cl(1mol/L,pH7.8)

酶和缓冲液
大肠杆菌β-半乳糖苷酶
该酶是商品化的(如 Sigma 公司)
附加试剂
本方案步骤 1 需要列在本章方案 5 中的试剂。
细胞和组织
转染了感兴趣 DNA 的哺乳动物培养细胞
使用第 16 章的某种转染方案,用带有半乳糖苷酶报道基因的质粒(如 CLONTECH 公司的报道分子系列载体;请见图 17-5) 转染细胞。

方法
1. 如方案 5 步骤 1~4 所述,用转染的细胞制备细胞抽提物。取约 30ul 抽提物测定β-半乳糖苷酶。所需抽提物的确切数量要根据驱动β-半乳糖苷酶基因表达的启动子的强度、转染效率和测定时的孵育时间来确定。如果要用热处理灭活内源性β-半乳糖苷酶,测定前把细胞裂解物在 50°C 孵育 45~60 min。预热处理也会使荧光素酶失活,所以如果使用预热处理,荧光素酶和β-半乳糖苷酶活性测定要分开用不同一份细胞裂解物进行。
2. 对于每个用于测定的转染细胞裂解物样品,混合:
100xMg2+溶液 3ul
1xONPG 66ul
细胞抽提物 30ul
0.1mol/L 磷酸钠(PH7.5) 201ul
阴性和阳性对照都是必需的,它们分别检査内源性抑制剂和β-半乳糖苷酶是否存在。所有对照实验应该含有 30ul 假转染细胞的裂解物。此外,阳性对照应该包括 1ul 商品化的大肠杆菌β-半乳糖苷酶制品<50 单位/ml。商品化的酶制品应该溶在 0.1mol/L 磷酸钠(PH7.5) 中,浓度为 3000 单位/ml。临用前,把 1ul β—半乳糖苷酶贮存液加到 60ul 0.1mol/L 磷酸钠(PH7.5) 中配成 50 单位/ml 的酶工作液。每单位大肠杆菌半乳糖苷酶定义为在 37°C,1 min 内水解 1umol ONPG 底物的酶量。
3. 反应液在 37°C 孵育 30 min 或者直到淡黄色出现。大多数细胞类型中,内源性β-半乳糖苷酶的背景非常低,允许孵育时间长到 4~6 h。
4. 每个管子加入 500ul 1mol/L Na2CO3 使反应终止。在分光光度计上读 420nm 波长的光密度值。
测量的线性范围是 0.2~0.8OD420。如果测量值在线性范围外, 用少一些蛋白抽提物进行重复实验。抽提物可以用 0.25mol/L Tris-Cl(pH7.8) 稀释以减低蛋白浓度。






