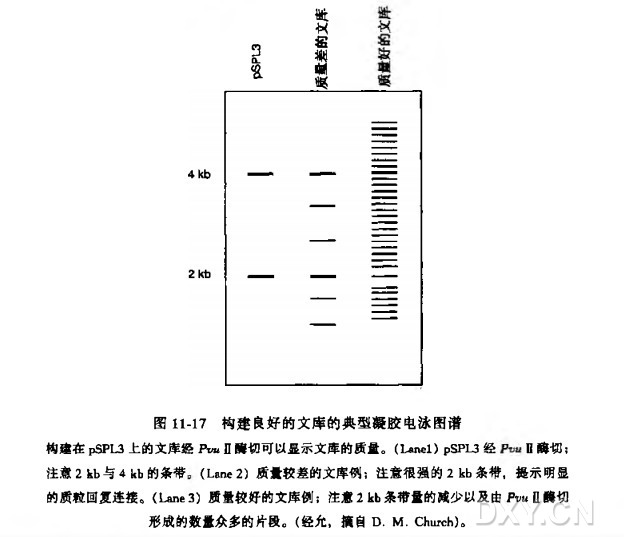
真核表达文库的构建与筛选实验
材料与仪器宿主细胞 质粒或λ噬菌体表达载体 包装提取物 电转化感受态大肠杆菌限制性内切核酸酶缓冲液 限制性内切核酸酶 通过 poly(A)+富集的 mRNA c
材料与仪器
宿主细胞 质粒或λ噬菌体表达载体 包装提取物 电转化感受态大肠杆菌
限制性内切核酸酶缓冲液 限制性内切核酸酶 通过 poly(A)+富集的 mRNA cDNA 文库 含适当抗生素的 Terrific 球脂平板 含适当抗生素的 Terrific 肉汤培养基
cDNA 合成试剂盒
限制性内切核酸酶缓冲液 限制性内切核酸酶 通过 poly(A)+富集的 mRNA cDNA 文库 含适当抗生素的 Terrific 球脂平板 含适当抗生素的 Terrific 肉汤培养基
cDNA 合成试剂盒
步骤
阶段一:在真核表达载体上构建 cDNA 文库
材料
缓冲液与溶液
10X 限制性内切核酸酶缓冲液
酶及缓冲液
限制性内切核酸酶
见步骤 3
核酸与寡核苷酸
通过 poly(A)+富集的 mRNA
mRNA 须提取自表达目标蛋自活性的细胞或组织,并经两轮 oligo(dT)-纤维素亲和层析纯化(见第 7 章,方案 3)。鉴定目标蛋白高表达组织或细胞系的方法应与表达克隆中的筛选方法相同。获知目标 mRNA 的大小对于表达克隆非常有益,可对 mRNA 进行分级分离,然后检测不同大小组分的翻译产物中靶标蛋白生物学活性以确定这一交分级分离的 mRMA 组分可注射入卵母细胞进而检测卵中靶标蛋白的活性,或者也可将 mRNA 组分转染培养的哺乳动物细胞(见第 16 章)。
专用设备
cDNA 合成试剂盒
多家生产商供应此试剂盒,其中通常包括制备 cDNA 库并将其连接λ噬菌体或质粒载体中所需的全部试剂(见信息拦"商品化的 cDNA 合成及文库构建试刑盒")。
附加试剂
本方案步骤 1 需要的试剂列在方案 1 阶段 1~4。
本方案步骤 2 需要的试剂列在方案 1 阶段 5。
本方案步骤 4 和 5 需要的试剂列在方案 1 阶段 6。
本方案步骤 8 可能需要列在第一章方案 26 的试剂。
载体与菌株
电转化感受态大肠杆菌
如选择质粒表达载体,制备(见第 1 章,方案 26) 或购买电转化感受态大肠杆菌作为 cDNA 文库的宿主细胞。转化效率至少应达到 5x108 克隆/ul 质粒 DNA。最好在表达克隆及筛选过程中只使用同一批制备的感受态细菌。
包装提取物
如选择λ噬菌体载体,则购买(或制备)髙滴度的包装提取物,用于将重组 cDNA 包装λ病毒颗粒中 (见信息栏“体外包装”)。包装提取物的滴度至少应达到109pfu/ug 病毒 DNA。
质粒或λ噬菌体表达载体
载体的选择取决于表达所用的宿主系统。如宿主是爪蟾卵母细胞,表达载体应选择λ菌体栽体成者在多克隆位点附近带有来源于 Sp6、T3 或 T7 噬菌体启动于的质粒载体(如表达载体λZAP Express、λExCell 和 pSPORT)。如使用哺乳动物细胞作为宿主,则选择带有强启动子(如人巨细胞病毒早期瞬时启动子)的质粒载体,并且带有强转录终止序列(如人生长激素基因 3'端序列或 SV40 晚期终止子序列)。这样的质粒包括 pCMV 系列质粒和质粒 pcDNA4(见表 11-5 和附录 3)。
方法
1. 用商品化试剂盒或按方案 1(阶段1~4)制备平末端的双链cDNA, 并在末端连接上合适的接头或衔接子。
2. 使用凝胶过滤层析按大小分级分离双链cDNA。细则参见方案 1 阶段5。
如目标mRNA大小已知,收集柱层析产物介于目标mRNA大小=1kb的组分。如大小未知,则将柱层析产物按以下大小分别收集:500~1500bp,1500~3000bp以及>300bp。
3. 双酶切 10~25ug 的质粒或λ噬菌体表达载体,cDNA 上接头-衔接子区域 5'和 3'端应具有相应的黏性末端。
重要:应确保酶切完全。应依次酶切而不是同时双酶切;酶切之间用酚: 氯仿抽提结合乙醇沉淀纯化 DNA, 只要可能就采用凝胶电泳检査酶切是否完全。
为确保在克隆之前表达载体的酶切完全,一些研究者在多克隆位点 SatⅠ和 NatⅠ(或其他双酶切位点组合)之间插人一段 200~300bp 的塞子(stuffer) 序列。这样酶切效率可随时得到监测, 并在某些情况下可增强载体的双酶切效果,因为多克隆位点区内的两种限制酶切位点通常很接近,将它们分开 200~300bp 可以消除因此而引起的酶切末端抑制现象。
4. 按不同的 cDNA 与载体(噬菌体臂或质粒 DNA) 分子比例进行连接预实验。优化连接反应过程细则参见本章方案1 中阶段 6 导言部分(也可见于阶段 6 的步骤 l)。
如已通过分级分离将 CDNA 分成大小不同的组分(见阶段 2 注意事项),则每一组分都必须分别进行连接反应效率检测。
5. 将每一连接反应产物取小部分包装λ噬菌体颗粒中。检测每一包装反应产生的感染颗粒的滴度。细则参见专栏“λ噬菌体在大肠杆菌菌株上铺板”和方案1阶段 6 之步骤 2~6。或者从每一连接反应产物中取小部分采用电穿孔法转化大肠杆菌(见第 1 章方案 26)。
6. 检测 6 个重组的λ噬菌体或质粒载体上的 cDNA 的大小是否合适,确定能产生最多重组克隆数的最佳连接反应 cDNA 与载体 DNA 比例,并计算按照此参数设置所构建的 cDNA 库的丰度。
7. 按照最佳连接反应中 cDNA 插入物与载体分子的比例,连接尽可能多的 cDNA 与λ噬菌体或质粒 DNA。
通常设置许多小的连接反应体系,而不是一个较大的反应体系。
8. 使用下述方法之一制备并分析重组子:
如果使用λ噬菌体载体:按包装提取物供应商提供的操作指南将连接产物 DNA 包装入λ噬菌体颗粒中,测定病毒贮存液滴度,并将之保存于 4°C。
如果使用质粒载体:取小部分连接反应产物电转化大肠杆菌以检测连接反应产生的可能重组子数(参见第 1 章方案 26)。
9. 应尽快进行真核表达文库的筛选。
阶段 2: 在真核表达载体上构建的 cDNA 文库的筛选
材料
缓冲液与溶液
贮存液,缓冲液和试剂组分见附录 1, 按合适比例稀释贮存液。
SM
酶和缓冲液
限制性内切核酸酶
特定的程序中所需要的限制性内切核酸。见步骤 1 和 3。
核苷酸与寡核苷酸
cDNA 文库,按此方案中阶段 1 所述制备
转染/注射实验的对照
在表达克隆中设置为阳性对照的 cDNA 的价值是难以估量的。如果可能,选择编码蛋白的生物活性与欲克隆的靶蛋白近似的 cDNA 作为对照。例如,欲克隆一个新的 K+通道蛋白的 cDNA, 则使用早先已克隆的 K+通道蛋白的 cDNA 作为阳性对照。对照 cDNA 用于确定合适的亚库容量以及转化/感染实验参数设置是否恰当。在进行步骤 1 之前,必须将阳性对照 cDNA 转入适当的大肠杆菌菌株(如使用质粒表达载体)或包装入λ噬菌体颗粒。当使用爪蟾卵母细胞进行转染/注射实验时,必须引入两个阴性对照:空载体质粒和不加模板 DNA 的转录反应体系组分。另外在步骤 1 中,包装有菌体表达空载体的噬菌体顆粒或已转人空表达载体质粒的大肠杆菌是必须的。
培养基
含适当抗生素的 Terrific 球脂平板
含适当抗生素的 Terrific 肉汤培养基(或其他丰富培养基)
附加试剂
本方案步骤 1 和步骤 2 可能需要商品化的质粒提取试剂盒(见第 1 章方案 9)。
本方案步骤 1 和步骤 3 可能需要第 16 章某一转染方案所需的试剂。
本方案步骤 1 和步骤 3 可能需要的试剂列在第 9 章方案 6。
本方案步骤 1 和步骤 3 可能需要将 mRNA 注射入爪蟾卵母细胞的必需试剂,见 Spector 等(1998a)。
本方案步骤 1 可能需要的试剂列在第 2 章方案 1 或 5 以及方案 23 或 24。
本方案步骤 1 需要用于检测阳性对照 cDNA 编码蛋白质生物活性的必须试剂。
本方案步骤 2 可能需要的试剂列在第 1 章方案 26 和箏 2 章方案 1 以及方案 23 或 24。
本方案步骤 4 需要用于检测靶蛋白生物活性的必须试剂。
本方案步骤 6 需要的试剂列在第 7、12、15 和 16 章。
细胞与组织
宿主细胞
卵母细胞取自雌性南非爪蟾,可从多处生物供应机构得到此种爪蟾(如 Carolina Biological Supply 或 Kons Scientific)。卵母细胞群表达注射入的 mRNA 的能力呈季节性变化,并受供体动物年龄和生理状态的影响。表达 mRNA 时遇到的困难有时可通过更换动物的供应来源解决。卵母细胞的分离方法见 Colman(1984),Spector 等(1998a) 和 Julius 等猴源的 COS 细胞或者 293 人胚胎肾细胞系的衍生细胞系由于其在转染时具有极高的转染效率而被选择用于哺乳动物瞬时表达的宿主细胞(Gluzman1981;Gorman1990)。不过许多其他的细胞系(例如 CHO 和 NIH-3T3) 也曾成功的应用于此(Naglich et al.1992;Bates et al,1993;Young et al.1993)。
在进行表达克隆前,检测未注射的卵母细胞或未转化转染细胞中靶标蛋白的生物学活性,应确保使用的表达宿主中靶蛋白活性处于几乎检测不到的水平。
方法
1. 设置一系列的预实验,优化用于筛选文库中目的 dDNA 克隆的转染和表达系统。最好采用一个早先已克隆的 cDNA 进行优化实验,并且已具备检测此 cDNA 编码的蛋白生物学活性的可靠方法。
如果使用真核质粒表达载体和培养细胞宿主
a. 挑取含有阳性对照 cDNA 质粒的大肠杆菌单菌落,接入 10 ml 丰富培养基中(如含 1 种选择性抗生素的 Terrific 肉汤培养基), 培养基中含有源自空载体转化大肠杆菌获得的 10、100、1000、10000 或 100000 个克隆。37°C 振摇过夜培养菌液至饱和。
b. 用商品化试剂盒纯化质粒 DNA,纯度应达到能够有效转染培养的哺乳动物细胞的要求(参见第 1 章方案 9 表 1-6)。
c. 应用第 16 章描述的一种或多种方法将制备的多种质粒样品转染培养的真核细胞,检测阳性对照 cDNA 编码蛋白的生物活性。
进行 cDNA 文库筛选时,选用产生最大信噪比而本底低到可接受水平的转染方法。
如果使用噬菌体 RNA 聚合酶(如 T3、T7 或 SP6) 进行质粒表达载体上的 cDNA 的转录并将产物 mRNA 注射到爪蟾卵母细胞
a. 按前述步骤 a 和 b 操作。
b. 利用文库构建时在 cDNA3'末端引入的稀有酶切位点,对收集并纯化的质粒 DNA 线性化处理,然后以之为模板体外转录为 mRNA(参见第 9 章方案 6)。
c. 将 mRNA 注射爪蟾卵母细胞,检测阳性对照 cDNA 编码蛋白的生物学活性,也可将 mRNA 转染其他适当的细胞系。
如使用含噬菌体编码的 RNA 聚合酶启动子的λ噬菌体载体作为表达载体
a. 制备一系列的噬菌体悬液,其中含有不同比例的空λ噬菌体载体与含有对照 cDNA 的重组λ噬菌体载体(10:1,100:1,1000:1 等等)。用大量噬菌体颗粒感染合适的大肠杆菌株,使细菌菌苔几乎溶解成片,或使液体培养基中生长的受感染细菌完全裂解(见第 2 章方案 1 或 5)。
b. 从平板上(见第 2 章方案 23) 或从液体培养基中(见第 2 章方案 24) 收集制备λ噬菌体 DNA。
c. 利用文库构建时在 CDNA3'末端引入的稀有酶切位点,线性化处理λ噬菌体 DNA, 并按第 9 章方案 6 描述的方法将 cDNA 体外转录为 mRNA。
d. 将 mRNA 注射到爪蟾卵母细抱,检测阳性对照 cDNA 编码蛋白的生物学活性。
2. 以步骤 1 中获得的结果作为大致的指导,将 cDNA 文库分成大小适当的筛选亚库, 用之转化或转染大肠杆菌。制备用于目标 cDNA 筛选所需的质粒或λ噬菌体 DNA。
如表达文库构建在质粒载体上并且文库在固体培养基生长
a. 从连接反应混合物中(阶段 1 步骤 8) 取足够数目的小份(例如 50~100 份,每份足以产生约 1000 个重组子),分别独立电转化大肠杆菌。将每份电转化产物全部铺在 1 个含适当抗生素的 Terrific 琼脂平板上,37°C 培养过夜。
每个平板上生长的克隆数应达到预期数。例如,筛选的库容置应达到 50000 克隆,则电转化所用的连接混合物应足够产生 50 个每个生长约 1000 个克隆的平板。转化培养物在铺平板之前可按步骤 b 在液体培养基培养。
b. 估计每个平板上的克隆数。将每个平板上的克隆刮入 5 ml 丰富培养基中(例如含选择性抗生素的 Terrific 肉汤培养基)。菌液培养至饱和后纯化质粒 DNA 用于筛选。
如表达文库构建在质粒载体而文库生长在液体培养基中
这一程序的优点在于省却了铺平板步骤,节省了时间与精力。同时,由于在琼脂平板生长不佳或者机械损伤导致的某些独立克隆丢失的可能降低了。
a. 从连接反应混合物中(阶段 1 步骤 8) 取足够数目的小份(例如 50~100 份,每份足以产生约 1000 个重组子),分别独立电转化大肠杆菌。在每份培养物中重组克隆数应达到预期数目。
b. 电转化后立即向每份菌液中加入 lml 的不含抗生素的丰富培养基(如 SOC 或 Terrific 肉汤培养基),37°C 在以非常慢的速度振摇培养1h。短暂的培养将使质粒带有的抗生素抗性基因得到表达,并积累至足以保护转化细菌的水平。
c. 取部分菌液分别接种 5 ml 培养液。培养至饱和后纯化质粒 DNA 用于筛选。
如表达文库构建在λ噬菌体载体并需筛选 10000 至 100000 个 cDNA 克隆
a. 取适当容量的包装混合物感染细菌平板制备半致密重组噬菌斑库。或者,用足够量的包装混合物使在液体培养基中生长的大肠杆菌完全裂解。
b. 用平板裂解法或液体培养法分离噬菌体 DNA(见第 2 章方案 23 或 24)。
如表达文库构建在λ噬菌体载体而需筛选不超过 10000 个 cDNA 克隆
a. 取与需筛选数目相同的重组噬菌体感染细菌平板,密度为每个 100 mm 平板产 1000pfu。
b. 噬菌斑形成后,每个平板加 2~3 ml 的 SM 以制备低滴度的平板裂解液,计算其滴度。
c. 用低滴度的平板裂解液感染液体细菌培养物,制备高滴度的噬菌体贮存液。
d. 用液体培养法纯化噬菌体 DNA(见第 2 章方案 24)。
3. 将纯化的克隆转移到适当的背景体系中以分析其表达
如克隆为纯化的质粒 DNA: 将质粒 DNA 转染培养的哺乳动物细胞,或以其为体外转录模板,用噬菌体 RNA 聚合酶制备 mKNA 并注射到爪蟾卵母细胞中。
如克隆为纯化的λ噬菌体 DNA: 线性化处理λ噬菌体 DNA, 以其为体外转录模板合成 mRNA 并注射到爪蟾卵母细胞中。
一个典型的转染实验使用 50~100 个平皿的培养细胞,可获 50000^100000 个 cDNA 克隆(每个平血含 1000 个独立克隆),以筛选是否表达目的生物活性。而一个典型亚库的 mRNA 注射 5 个爪蟾卵母细胞,每个亚库含 1000 个独立克隆,则需 250~500 个卵母细胞用于 50000~100000 个 cDNA 的生物活性筛选。
4. 检测目标 cDNA 编码蛋白的生物学活性。
5. 鉴定出阳性亚库后不断将其分成越来越小的库,重复检测直至分离鉴定得到目的 cDNA 单克隆。实现这一目标的最简单方法是使用来自阳性亚库的重组质粒或λ噬菌体 DNA 纯化产物,步骤如下:
a. 将阳性(初级)亚库质粒或噬菌体 DNA 分为小份,每份中可产生的重组转化克隆或噬菌斑数约为初级亚库的十分之一。
1 个含 10000 个独立克隆的初级亚库需分为约 30 份,每份可产生约 1000 个克隆或噬菌斑。
b. 重复上述步骤 3 和 4。在重复筛选时应将初筛阳性亚库引入作为阳性对照。
c. 重复分选步骤直至得到表达靶标生物活性的单个重组子。必须确保用于最终筛选的噬菌体或质粒 DNA 只来源自单个噬菌斑或菌体克隆。
6. 利用 DNA 测序(第 12 章),表达(第 15 或 16 章)和 RNA 杂交(第 7 章)的方法鉴定挑取的编码靶标生物活性的 cDNA 单克隆。
如果重组子不包含 cDNA 的全部编码区,则可用初次挑选的 cDNA 作为探针,利用高严谨度杂交从 cDNA 文库中筛选更多的重组子。
材料
缓冲液与溶液
10X 限制性内切核酸酶缓冲液
酶及缓冲液
限制性内切核酸酶
见步骤 3
核酸与寡核苷酸
通过 poly(A)+富集的 mRNA
mRNA 须提取自表达目标蛋自活性的细胞或组织,并经两轮 oligo(dT)-纤维素亲和层析纯化(见第 7 章,方案 3)。鉴定目标蛋白高表达组织或细胞系的方法应与表达克隆中的筛选方法相同。获知目标 mRNA 的大小对于表达克隆非常有益,可对 mRNA 进行分级分离,然后检测不同大小组分的翻译产物中靶标蛋白生物学活性以确定这一交分级分离的 mRMA 组分可注射入卵母细胞进而检测卵中靶标蛋白的活性,或者也可将 mRNA 组分转染培养的哺乳动物细胞(见第 16 章)。
专用设备
cDNA 合成试剂盒
多家生产商供应此试剂盒,其中通常包括制备 cDNA 库并将其连接λ噬菌体或质粒载体中所需的全部试剂(见信息拦"商品化的 cDNA 合成及文库构建试刑盒")。
附加试剂
本方案步骤 1 需要的试剂列在方案 1 阶段 1~4。
本方案步骤 2 需要的试剂列在方案 1 阶段 5。
本方案步骤 4 和 5 需要的试剂列在方案 1 阶段 6。
本方案步骤 8 可能需要列在第一章方案 26 的试剂。
载体与菌株
电转化感受态大肠杆菌
如选择质粒表达载体,制备(见第 1 章,方案 26) 或购买电转化感受态大肠杆菌作为 cDNA 文库的宿主细胞。转化效率至少应达到 5x108 克隆/ul 质粒 DNA。最好在表达克隆及筛选过程中只使用同一批制备的感受态细菌。
包装提取物
如选择λ噬菌体载体,则购买(或制备)髙滴度的包装提取物,用于将重组 cDNA 包装λ病毒颗粒中 (见信息栏“体外包装”)。包装提取物的滴度至少应达到109pfu/ug 病毒 DNA。
质粒或λ噬菌体表达载体
载体的选择取决于表达所用的宿主系统。如宿主是爪蟾卵母细胞,表达载体应选择λ菌体栽体成者在多克隆位点附近带有来源于 Sp6、T3 或 T7 噬菌体启动于的质粒载体(如表达载体λZAP Express、λExCell 和 pSPORT)。如使用哺乳动物细胞作为宿主,则选择带有强启动子(如人巨细胞病毒早期瞬时启动子)的质粒载体,并且带有强转录终止序列(如人生长激素基因 3'端序列或 SV40 晚期终止子序列)。这样的质粒包括 pCMV 系列质粒和质粒 pcDNA4(见表 11-5 和附录 3)。
方法
1. 用商品化试剂盒或按方案 1(阶段1~4)制备平末端的双链cDNA, 并在末端连接上合适的接头或衔接子。
2. 使用凝胶过滤层析按大小分级分离双链cDNA。细则参见方案 1 阶段5。
如目标mRNA大小已知,收集柱层析产物介于目标mRNA大小=1kb的组分。如大小未知,则将柱层析产物按以下大小分别收集:500~1500bp,1500~3000bp以及>300bp。
3. 双酶切 10~25ug 的质粒或λ噬菌体表达载体,cDNA 上接头-衔接子区域 5'和 3'端应具有相应的黏性末端。
重要:应确保酶切完全。应依次酶切而不是同时双酶切;酶切之间用酚: 氯仿抽提结合乙醇沉淀纯化 DNA, 只要可能就采用凝胶电泳检査酶切是否完全。
为确保在克隆之前表达载体的酶切完全,一些研究者在多克隆位点 SatⅠ和 NatⅠ(或其他双酶切位点组合)之间插人一段 200~300bp 的塞子(stuffer) 序列。这样酶切效率可随时得到监测, 并在某些情况下可增强载体的双酶切效果,因为多克隆位点区内的两种限制酶切位点通常很接近,将它们分开 200~300bp 可以消除因此而引起的酶切末端抑制现象。
4. 按不同的 cDNA 与载体(噬菌体臂或质粒 DNA) 分子比例进行连接预实验。优化连接反应过程细则参见本章方案1 中阶段 6 导言部分(也可见于阶段 6 的步骤 l)。
如已通过分级分离将 CDNA 分成大小不同的组分(见阶段 2 注意事项),则每一组分都必须分别进行连接反应效率检测。
5. 将每一连接反应产物取小部分包装λ噬菌体颗粒中。检测每一包装反应产生的感染颗粒的滴度。细则参见专栏“λ噬菌体在大肠杆菌菌株上铺板”和方案1阶段 6 之步骤 2~6。或者从每一连接反应产物中取小部分采用电穿孔法转化大肠杆菌(见第 1 章方案 26)。
6. 检测 6 个重组的λ噬菌体或质粒载体上的 cDNA 的大小是否合适,确定能产生最多重组克隆数的最佳连接反应 cDNA 与载体 DNA 比例,并计算按照此参数设置所构建的 cDNA 库的丰度。
7. 按照最佳连接反应中 cDNA 插入物与载体分子的比例,连接尽可能多的 cDNA 与λ噬菌体或质粒 DNA。
通常设置许多小的连接反应体系,而不是一个较大的反应体系。
8. 使用下述方法之一制备并分析重组子:
如果使用λ噬菌体载体:按包装提取物供应商提供的操作指南将连接产物 DNA 包装入λ噬菌体颗粒中,测定病毒贮存液滴度,并将之保存于 4°C。
如果使用质粒载体:取小部分连接反应产物电转化大肠杆菌以检测连接反应产生的可能重组子数(参见第 1 章方案 26)。
9. 应尽快进行真核表达文库的筛选。
阶段 2: 在真核表达载体上构建的 cDNA 文库的筛选
材料
缓冲液与溶液
贮存液,缓冲液和试剂组分见附录 1, 按合适比例稀释贮存液。
SM
酶和缓冲液
限制性内切核酸酶
特定的程序中所需要的限制性内切核酸。见步骤 1 和 3。
核苷酸与寡核苷酸
cDNA 文库,按此方案中阶段 1 所述制备
转染/注射实验的对照
在表达克隆中设置为阳性对照的 cDNA 的价值是难以估量的。如果可能,选择编码蛋白的生物活性与欲克隆的靶蛋白近似的 cDNA 作为对照。例如,欲克隆一个新的 K+通道蛋白的 cDNA, 则使用早先已克隆的 K+通道蛋白的 cDNA 作为阳性对照。对照 cDNA 用于确定合适的亚库容量以及转化/感染实验参数设置是否恰当。在进行步骤 1 之前,必须将阳性对照 cDNA 转入适当的大肠杆菌菌株(如使用质粒表达载体)或包装入λ噬菌体颗粒。当使用爪蟾卵母细胞进行转染/注射实验时,必须引入两个阴性对照:空载体质粒和不加模板 DNA 的转录反应体系组分。另外在步骤 1 中,包装有菌体表达空载体的噬菌体顆粒或已转人空表达载体质粒的大肠杆菌是必须的。
培养基
含适当抗生素的 Terrific 球脂平板
含适当抗生素的 Terrific 肉汤培养基(或其他丰富培养基)
附加试剂
本方案步骤 1 和步骤 2 可能需要商品化的质粒提取试剂盒(见第 1 章方案 9)。
本方案步骤 1 和步骤 3 可能需要第 16 章某一转染方案所需的试剂。
本方案步骤 1 和步骤 3 可能需要的试剂列在第 9 章方案 6。
本方案步骤 1 和步骤 3 可能需要将 mRNA 注射入爪蟾卵母细胞的必需试剂,见 Spector 等(1998a)。
本方案步骤 1 可能需要的试剂列在第 2 章方案 1 或 5 以及方案 23 或 24。
本方案步骤 1 需要用于检测阳性对照 cDNA 编码蛋白质生物活性的必须试剂。
本方案步骤 2 可能需要的试剂列在第 1 章方案 26 和箏 2 章方案 1 以及方案 23 或 24。
本方案步骤 4 需要用于检测靶蛋白生物活性的必须试剂。
本方案步骤 6 需要的试剂列在第 7、12、15 和 16 章。
细胞与组织
宿主细胞
卵母细胞取自雌性南非爪蟾,可从多处生物供应机构得到此种爪蟾(如 Carolina Biological Supply 或 Kons Scientific)。卵母细胞群表达注射入的 mRNA 的能力呈季节性变化,并受供体动物年龄和生理状态的影响。表达 mRNA 时遇到的困难有时可通过更换动物的供应来源解决。卵母细胞的分离方法见 Colman(1984),Spector 等(1998a) 和 Julius 等猴源的 COS 细胞或者 293 人胚胎肾细胞系的衍生细胞系由于其在转染时具有极高的转染效率而被选择用于哺乳动物瞬时表达的宿主细胞(Gluzman1981;Gorman1990)。不过许多其他的细胞系(例如 CHO 和 NIH-3T3) 也曾成功的应用于此(Naglich et al.1992;Bates et al,1993;Young et al.1993)。
在进行表达克隆前,检测未注射的卵母细胞或未转化转染细胞中靶标蛋白的生物学活性,应确保使用的表达宿主中靶蛋白活性处于几乎检测不到的水平。
方法
1. 设置一系列的预实验,优化用于筛选文库中目的 dDNA 克隆的转染和表达系统。最好采用一个早先已克隆的 cDNA 进行优化实验,并且已具备检测此 cDNA 编码的蛋白生物学活性的可靠方法。
如果使用真核质粒表达载体和培养细胞宿主
a. 挑取含有阳性对照 cDNA 质粒的大肠杆菌单菌落,接入 10 ml 丰富培养基中(如含 1 种选择性抗生素的 Terrific 肉汤培养基), 培养基中含有源自空载体转化大肠杆菌获得的 10、100、1000、10000 或 100000 个克隆。37°C 振摇过夜培养菌液至饱和。
b. 用商品化试剂盒纯化质粒 DNA,纯度应达到能够有效转染培养的哺乳动物细胞的要求(参见第 1 章方案 9 表 1-6)。
c. 应用第 16 章描述的一种或多种方法将制备的多种质粒样品转染培养的真核细胞,检测阳性对照 cDNA 编码蛋白的生物活性。
进行 cDNA 文库筛选时,选用产生最大信噪比而本底低到可接受水平的转染方法。
如果使用噬菌体 RNA 聚合酶(如 T3、T7 或 SP6) 进行质粒表达载体上的 cDNA 的转录并将产物 mRNA 注射到爪蟾卵母细胞
a. 按前述步骤 a 和 b 操作。
b. 利用文库构建时在 cDNA3'末端引入的稀有酶切位点,对收集并纯化的质粒 DNA 线性化处理,然后以之为模板体外转录为 mRNA(参见第 9 章方案 6)。
c. 将 mRNA 注射爪蟾卵母细胞,检测阳性对照 cDNA 编码蛋白的生物学活性,也可将 mRNA 转染其他适当的细胞系。
如使用含噬菌体编码的 RNA 聚合酶启动子的λ噬菌体载体作为表达载体
a. 制备一系列的噬菌体悬液,其中含有不同比例的空λ噬菌体载体与含有对照 cDNA 的重组λ噬菌体载体(10:1,100:1,1000:1 等等)。用大量噬菌体颗粒感染合适的大肠杆菌株,使细菌菌苔几乎溶解成片,或使液体培养基中生长的受感染细菌完全裂解(见第 2 章方案 1 或 5)。
b. 从平板上(见第 2 章方案 23) 或从液体培养基中(见第 2 章方案 24) 收集制备λ噬菌体 DNA。
c. 利用文库构建时在 CDNA3'末端引入的稀有酶切位点,线性化处理λ噬菌体 DNA, 并按第 9 章方案 6 描述的方法将 cDNA 体外转录为 mRNA。
d. 将 mRNA 注射到爪蟾卵母细抱,检测阳性对照 cDNA 编码蛋白的生物学活性。
2. 以步骤 1 中获得的结果作为大致的指导,将 cDNA 文库分成大小适当的筛选亚库, 用之转化或转染大肠杆菌。制备用于目标 cDNA 筛选所需的质粒或λ噬菌体 DNA。
如表达文库构建在质粒载体上并且文库在固体培养基生长
a. 从连接反应混合物中(阶段 1 步骤 8) 取足够数目的小份(例如 50~100 份,每份足以产生约 1000 个重组子),分别独立电转化大肠杆菌。将每份电转化产物全部铺在 1 个含适当抗生素的 Terrific 琼脂平板上,37°C 培养过夜。
每个平板上生长的克隆数应达到预期数。例如,筛选的库容置应达到 50000 克隆,则电转化所用的连接混合物应足够产生 50 个每个生长约 1000 个克隆的平板。转化培养物在铺平板之前可按步骤 b 在液体培养基培养。
b. 估计每个平板上的克隆数。将每个平板上的克隆刮入 5 ml 丰富培养基中(例如含选择性抗生素的 Terrific 肉汤培养基)。菌液培养至饱和后纯化质粒 DNA 用于筛选。
如表达文库构建在质粒载体而文库生长在液体培养基中
这一程序的优点在于省却了铺平板步骤,节省了时间与精力。同时,由于在琼脂平板生长不佳或者机械损伤导致的某些独立克隆丢失的可能降低了。
a. 从连接反应混合物中(阶段 1 步骤 8) 取足够数目的小份(例如 50~100 份,每份足以产生约 1000 个重组子),分别独立电转化大肠杆菌。在每份培养物中重组克隆数应达到预期数目。
b. 电转化后立即向每份菌液中加入 lml 的不含抗生素的丰富培养基(如 SOC 或 Terrific 肉汤培养基),37°C 在以非常慢的速度振摇培养1h。短暂的培养将使质粒带有的抗生素抗性基因得到表达,并积累至足以保护转化细菌的水平。
c. 取部分菌液分别接种 5 ml 培养液。培养至饱和后纯化质粒 DNA 用于筛选。
如表达文库构建在λ噬菌体载体并需筛选 10000 至 100000 个 cDNA 克隆
a. 取适当容量的包装混合物感染细菌平板制备半致密重组噬菌斑库。或者,用足够量的包装混合物使在液体培养基中生长的大肠杆菌完全裂解。
b. 用平板裂解法或液体培养法分离噬菌体 DNA(见第 2 章方案 23 或 24)。
如表达文库构建在λ噬菌体载体而需筛选不超过 10000 个 cDNA 克隆
a. 取与需筛选数目相同的重组噬菌体感染细菌平板,密度为每个 100 mm 平板产 1000pfu。
b. 噬菌斑形成后,每个平板加 2~3 ml 的 SM 以制备低滴度的平板裂解液,计算其滴度。
c. 用低滴度的平板裂解液感染液体细菌培养物,制备高滴度的噬菌体贮存液。
d. 用液体培养法纯化噬菌体 DNA(见第 2 章方案 24)。
3. 将纯化的克隆转移到适当的背景体系中以分析其表达
如克隆为纯化的质粒 DNA: 将质粒 DNA 转染培养的哺乳动物细胞,或以其为体外转录模板,用噬菌体 RNA 聚合酶制备 mKNA 并注射到爪蟾卵母细胞中。
如克隆为纯化的λ噬菌体 DNA: 线性化处理λ噬菌体 DNA, 以其为体外转录模板合成 mRNA 并注射到爪蟾卵母细胞中。
一个典型的转染实验使用 50~100 个平皿的培养细胞,可获 50000^100000 个 cDNA 克隆(每个平血含 1000 个独立克隆),以筛选是否表达目的生物活性。而一个典型亚库的 mRNA 注射 5 个爪蟾卵母细胞,每个亚库含 1000 个独立克隆,则需 250~500 个卵母细胞用于 50000~100000 个 cDNA 的生物活性筛选。
4. 检测目标 cDNA 编码蛋白的生物学活性。
5. 鉴定出阳性亚库后不断将其分成越来越小的库,重复检测直至分离鉴定得到目的 cDNA 单克隆。实现这一目标的最简单方法是使用来自阳性亚库的重组质粒或λ噬菌体 DNA 纯化产物,步骤如下:
a. 将阳性(初级)亚库质粒或噬菌体 DNA 分为小份,每份中可产生的重组转化克隆或噬菌斑数约为初级亚库的十分之一。
1 个含 10000 个独立克隆的初级亚库需分为约 30 份,每份可产生约 1000 个克隆或噬菌斑。
b. 重复上述步骤 3 和 4。在重复筛选时应将初筛阳性亚库引入作为阳性对照。
c. 重复分选步骤直至得到表达靶标生物活性的单个重组子。必须确保用于最终筛选的噬菌体或质粒 DNA 只来源自单个噬菌斑或菌体克隆。
6. 利用 DNA 测序(第 12 章),表达(第 15 或 16 章)和 RNA 杂交(第 7 章)的方法鉴定挑取的编码靶标生物活性的 cDNA 单克隆。
如果重组子不包含 cDNA 的全部编码区,则可用初次挑选的 cDNA 作为探针,利用高严谨度杂交从 cDNA 文库中筛选更多的重组子。