外显子捕获与扩增
材料与仪器大肠杆菌菌株 HB101 质粒 pSPL3 COS-7 细胞 载体 pBluescriptⅡ 大肠杆菌 DH5αpSPL3 多克隆位点图谱 限制性内切
材料与仪器
大肠杆菌菌株 HB101 质粒 pSPL3 COS-7 细胞 载体 pBluescriptⅡ 大肠杆菌 DH5α
pSPL3 多克隆位点图谱 限制性内切核酸酶 PvuⅡ T4DNA 连接酶 LB 琼脂平板 黏粒载体 TE SOC 培养基 琼脂糖凝胶 LB 肉汤培养基 PBS 胰酶-EDTA 溶液 DNA DMEM DEPC 处理水 乙醇 NaCl TMK 缓冲液 SDS DTT dNTP 溶液 Bst XI EcoR V Mo-MLV 反转录酶 Taq DNA 聚合酶 DNA 尿嘧啶糖基酶 RNase 抑制剂
水浴箱 离心转头 电穿孔转染设备以 电转染槽 组织培养平皿 宽口加样器头 细胞刮子或橡胶刮 聚苯乙烯离心管 热循环仪 多通道加样器或加样装置
pSPL3 多克隆位点图谱 限制性内切核酸酶 PvuⅡ T4DNA 连接酶 LB 琼脂平板 黏粒载体 TE SOC 培养基 琼脂糖凝胶 LB 肉汤培养基 PBS 胰酶-EDTA 溶液 DNA DMEM DEPC 处理水 乙醇 NaCl TMK 缓冲液 SDS DTT dNTP 溶液 Bst XI EcoR V Mo-MLV 反转录酶 Taq DNA 聚合酶 DNA 尿嘧啶糖基酶 RNase 抑制剂
水浴箱 离心转头 电穿孔转染设备以 电转染槽 组织培养平皿 宽口加样器头 细胞刮子或橡胶刮 聚苯乙烯离心管 热循环仪 多通道加样器或加样装置
步骤
阶段 1: 文库的构建
材料
缓冲液与溶液
按合适比例稀释贮存液。
ATP(10 mmol/L)
酚:氯仿(1:1,V/V)
TE(pH8.0)
酶及缓冲液
PvuⅡ
限制性内切核酸酶
pSPL3 多克隆位点图谱见图 11-16
T4DNA 连接酶
凝胶
琼脂糖凝胶(0.9%m/V), 用 TAE 配制
见步骤 3
琼脂糖凝胶,预制
见步骤 1
核酸与寡核苷酸
黏粒载体、大肠杆菌人工染色体或酵母人工染色体 DNA, 含有靶标基因组 DNA 区域。
用于分析的重组子 DNA 纯化方法见第 4 章。
或基因组 DNA
按第 6 章提供的方法之一制备
培养基
含 50ug/ml 氨苄青霉素的 LB 琼脂平板
参见步骤 8 决定平板的合适规格。
含 50ug/ml 氨苄青霉素的 LB 肉汤培养基
SOC 培养基
专用设备
预设溫度为 15°C 和 65°C 的水浴
附加试剂
本方案步骤 8 需要的试剂列在第 1 章,方案 20。
本方案步骤 6 需要的转化所需试剂列在第 1 章,方案 23、24 或 25。
本方案步骤 10 和 12 需要的试剂列在第 1 章,方案 1 或 9。
载体与菌株
大肠杆菌菌株 HB101, 处于转化感受态
按第 1 章,方案 23,24 或 25 制备。
质粒 pSPL3
Life Technologies 公司提供单独的或作为试剂盒组分的质粒 pSPL3。
方法
1. 对 pSPL3 进行限制酶切以插入基因组 DNA(pSPL3 多克隆位点图谱见图 11-16)。对线性化的质粒 DNA 去磷酸化处理,电泳并从凝胶中回收纯化质粒。
质粒 DNA 酶切完全非常重要,产物应为大小约 6kb 的单一片段。
2. 用与上一步相同的限制酶消化 1~2ug 的基因组 DNA 或含有目的基因组 DNA 的重组质粒。
3. 用 0.9% 的琼脂糖凝胶电泳(TAE 体系)分析 10% 的基因组酶切产物。
基因组 DNA 须酶切完全而无降解。凝胶电泳分析时,注意观察有无污染细菌(或酵母)基因组 DNA, 污染的 DNA 通常呈弥傲的背景条带。
4. 将基因组 DNA 酶切体系置 65°C15 min 终止酶切反应,酚: 氯仿抽提并用标准的乙醇沉淀法回收 DNA。产物溶于 TE(pH8.0), 浓度为 100ug/ml。
5. 混合以下组分将基因组 DNA 连接到载体上:
酶切后的基因组 DNA 150ng
酶切并经去磷酸化的 PSPL3 50ng
10x 连接反应缓冲液 1ul
T4 噬菌体 DNA 连接酶 10Weiss 单位
加 H2O 至 10ul
室温温育 2~3 h 或 15°C 过夜。
10X 连接反应缓冲液组分已添加 ATP, 则反应混合物中可加入更大体积的载体或外源 DNA。使用商品化的含 ATP 的连接续冲液,则无须添加 ATP。确保引入只有载体 DNA 的对照,这对于评价构建的文库的质量非常重要。
6. 用连接反应产物转化 40ul 的 HB101 感受态细胞。
确保用阳性对照(载体 DNA) 和阴性对照(无 DNA 体系)同时转化以评价转化效率。
重要:由于在其他菌株中 pSPL3 复制不稳定,使用 HB101 作为文库和载体扩增的宿主是必须的(Churchand Buckler1999)。
7. 转化后菌液中加入 800ul 的 SOC 培养基,37°C 培养 30~45 min 使质粒编码的抗生素抗性标记基因表达。
8. 在氨苄青霉素存在下 37°C 摇菌过夜以扩增文库。
如使用单个黏粒:将 100ul 转化混合物涂布一个含 50ug/ml 氨苄青霉素的 LB 琼脂平板。剩余的加入含 50ug/ml 氨苄青霉素的 LB 肉汤液体培养基 2 ml 继续培养。
取小量转化物在 LB 平板上培养可评价转化效率。
如使用 BAC、PAC 或黏粒库:将所有转化混合物涂布在多个 50ug/ml 氨苄青霉素的 LB 琼脂平板(150 mm) 上。
这样处理是为了消除因营养竞争而导致的某些克隆的优势生长,使构建的文库更具代表性。
9. 通过比较重组子与非重组子数目估计连接效率(也就是与只有 pSPL3 的连接混合物转化 HB101 所得克隆数进行比较)。
重组子至少应达到非重组子的 500 倍到 1000 倍。
10. 如在 150 mm 平板上进行文库扩增,直接进入步骤 11。对于在液体肉汤培养基中扩增的基因组文库,用标准的碱变性法(见第 1 章,方案 1) 或质粒提取试剂盒纯化质粒,然后进入步骤 13。
11. 如整个库铺在大的 LB 琼脂平板上,则加入 10 ml 肉汤培养基浸没平板,并小心从琼脂表面将菌落刮下来,尽量减少刮入肉汤中的琼脂量。
12. 用经过修改的标准碱变性法小量质粒提取程序纯化步骤 11 中获得样品中的质粒,依次加入细菌沉淀中的试剂量调整为碱裂解液Ⅰ(300ul), 裂解液Ⅱ(600ul) 及裂解液Ⅲ(450ul)。为简化程序,在加入碱裂解液 I 后,将细菌悬液移入一个 2 ml 离心管中,这样其余程序可在此离心管中完成。在加入溶裂解液Ⅲ并离心后,将粗制的质粒上淸分为两份置于两个 1.5 ml 离心管中。用酚:氯仿及氯仿对上清进行抽提,获得的上清用异戊醇沉淀,最后合并两管中的 DNA 重悬液。也可用商品化的质粒提取试剂食完成此步(第 1 章,方案 9)。
13. 取部分纯化后的质粒 DNA 用 PvuⅡ进行酶切,通过电泳观察构建的文库质量。
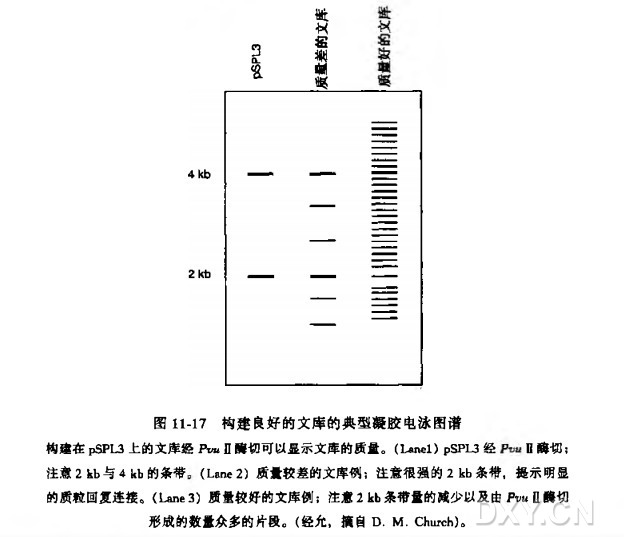
PvuⅡ酶切位点靠近质粒的多克隆位点。空载体酶切产物电泳显示 4kb 和 2kb 的条带。童组克隆经切割仍可见明显的 4kb 条带,但 2kb 的条带则应很微弱或没有。2kb 条带如很明显則提示文库的质量不佳,或者 (但可能性较小)基因组 DNA 经 PvuⅡ切割成大多为 2kb 的片段(图 11-17)。如文库的质量令人满童,则可用于实验的下一步骤。
阶段 2: 电穿孔法将文库转染 COS-7 细胞
材料
缓冲液与溶液
按合适比例稀释贮存液。
无二价阳离子的磷酸缓冲液(PBS)
酶及缓冲液
胰酶-EDTA 溶液
核酸与寡核苷酸
DNA
用于转染的质粒 DNA 制备见本方案阶段 1, 步骤 10~12。
用作对照的质粒载体(步骤 3)
培养基
含 10% 热灭活胎牛血清的 Dulbecco's modified Eagle's 培养基(DMEM)
离心转头
Sorvall H1000B 转头或等同规格转头
专用设备
电穿孔转染设备以及 0.4 cm 宽的电转染槽
组织培养平皿(100 mm)
宽口加样器头
细胞与组织
COS-7 细胞
细胞须在含 10% 热灭活胎牛血清的 DMEM 培养至 75%—85% 致密。关于细胞的处理细节,包括胰酶消化,见 Spector 等(1998b)。
方法
1. 用无二价阳离子的 PBS 洗涤单层 C0S-7 细胞。通过胰酶-EDTA 处理将细胞从平皿表面消化下来。4°C、250 g(Sorvall H1000B 转头上相当于 1100r/min) 离心 10 min 回收细胞。
重要:在整个过程中须保持 COS-7 细胞处于预冷状态。
关于细胞胰酶消化细节见 Spector 等(1998b)
2. 将用于转染的 DNA 样品溶于无二价阳离子的 PBS 并调整至 100ul。
转染所需的 DNA 量应按第 16 章,方案 5 进行优化,
3. 用 700ul 无二价阳离子的 PBS 重悬 4X106COS-7 细胞。在预冷的电转染槽中混合细胞与 DNA(槽内宽 0.4 cm)。将混合物放置冰上 10 min。
PBS 体系中如含二价阳离子,将导致电转染时产生电弧,可破坏电穿孔仅。
确保应用空载体 DNA 进行电转化,作为实验对照。
4. 小心重悬细胞,按 1.2kV(3kV/cm) 和 25uF 进行电穿孔转染实验。迅速将电转槽重置于冰上,并放置 10 min。
电穿孔转染条件按第 16 章,方案 5 描述的方法进行优化。
5. 用宽口加样器头将 1x106 的电转染后的细咆转入 100 mm 的组织培养平皿中,每个平皿已加入 10 ml 预热至 37°C 的含 10% 热灭活胎牛血清的 DMEM 培养基。在设定 37°C、5%~7%CO2 及一定湿度的培养箱中培养 48~72 h。
阶段 3:mRNA 的提取
材料
缓冲液与溶液
按合适比例稀释贮存液。
DEPC 处理水
乙醇
NaCl(5mol/L)
酚
酚:氯仿
无二价阳离子的磷酸缓冲液(PBS)
SDS(5%m/V)
TMK 缓冲液
10 mmol/LTris-HCl(pH7.5)
10 mmol/LKCl
1 mmol/LMgCl2
Triton X-100(10%V/V) 或 Nonidet P-40(4%,V/V)
离心转头
Sorvall H1000B 转头或等同规格转头
专用设备
细胞刮子或橡胶刮
聚苯乙烯离心管(15 ml), 冰上预冷至 0°C
细胞与组织
分别经重组 pSPL3 和非重组 pSPL3 转染的 COS-7 细胞
方法
1. 用冰预冷的不含钙、镁离子的 PBS 洗涤平皿中的转染 COS-7 细胞三次。洗涤过程中将平皿保持在冰上。
2. 每个平皿中加入 10 ml 预冷的 PBS。保持平皿在冰上,小心的将细胞刮除下来。
3. 将细胞悬液转入预冷的 15 ml 聚苯乙烯离心管中。
使用透明的聚苯乙烯离心管,有利于步骤 8、9 中不含细胞核的胞浆的回收。
4.4°C、300 g(Sorvall H1000B 转头上相当于 1200r/min) 离心 8 min 回收细胞。
5. 尽可能倾去上清,并用加样器除去残存的上清。
6. 在 300ulTFK 缓冲液中重悬 1X106 至 2x106 的 COS 细胞,冰上放置 5 min。
7. 加入 15ul 的 10% 的 Triton X-100 或 4% 的 Nonidet P-40, 冰上放置 5 min。
加入非离子去污剂可导致质膜的轻微破解而核膜保持完整。
8.4°C、500 g(Sorvall H1000B 转头上相当于 1500r/min) 离心 5 min 沉淀细胞核。
9. 将上清移入预冷的 1.5 ml 小离心管中。
重要:移取上淸时应异常小心,切不可触及细胞核沉淀。如核膜破裂会导致基因组 DNA 污染,样品将非常黏期而难以吸取。
10. 加入 20ul 的 5%SDS 和 300ul 的酚,剧烈振荡后最大速度离心 5 min,样品将分为有机相和水相。
11. 将水相移入含 300ul 酚: 氯仿的 1.5 ml 小离心管中,剧烈振荡后室温最大速度离心 3 min 进行分相。
12. 移取上层的水相至预冷的 1.5 ml 小离心管中,加入 120 的 5mol/LNaCl 和 750ul 的乙醇。-20°C 放置 2~3 h 或-80°C 放置 30 min 以沉淀 RNA。
核酸在乙醇中比在水中更稳定。如长期保存,RNA 应置于乙醇中-80°C 冻存(见第 7 章,方案 1 结尾部分的专栏“RNA 的保存")。
13.4°C、最大速度离心 10 min 回收 RNA。
14. 弃上清并用 70% 乙醇洗涤沉淀。空气干燥后,将沉淀重悬于 20 g 的 DEPC 处理水中。
阶段 4: 反转录 PCR
材料
缓冲液与溶液
按合适比例稀释贮存液
10x 扩增缓冲液
氯仿
DEPC 处理水
DTT(lmol/L)
dNTP 溶液,每种核苷酸浓度为 1.25 mmol/L
酚
RNase 抑制剂
酶及缓冲液
Bst XI
EcoR V
Mo-MLV 反转录酶
Taq DNA 聚合酶
DNA 尿嘧啶糖基酶(1 单位/ul)

凝胶
琼脂糖凝胶(1.5%m/V), 用 TBE 配制
核酸与寡核苷酸
寡核苷酸引物 [20 mmol/L,TE(pH8.0) 配制]

分别提取自转染有对照载体和重组载体的 COS-7 细胞的 RNA(阶段 3)。
培养基
含 50ug/ml 氨苄青霉素的 LB 琼脂平板
专用设备
自动微量加样器所用的加样器尖头
微量离心管(PCR 扩增用 0.5 ml 薄壁离心管,无 RNase)
带退尖头装置的自动加样器
可设置方案中反应程序的热循环仪
如热循环仪无热盖. 使用矿物油或封口石蜡防止 PCR 反应混合物的蒸发。封□石蜡不仅可防止蒸发,还可起到在反应混合物加热之前使反应组分(如引物与模板)暂时隔铯的效果。这可防止在反应的起始阶段由于引物非特异的结合模板引发的扩增。
预设溫至 42°C、55°C 和 65°C 的水浴
附加试剂
本方案步骤 14 需要的试剂列在第 1 章,方案 25。
载体与菌株
大肠杆菌 DH5α(或其他可产生α互补的菌株)
载体 pBluescriptⅡ(KS 或 SK)(Stratagene 公司)
方法
cDNA 的合成
1. 以 SA2 寡核苷酸作为引物,用步骤 3 中获得的胞浆 RNA 作模板制备 cDNA 第一链。
在 1 个无 RNase 的 0.5 ml 离心管中混合以下试剂:
RNA 3ul
10x 圹增缓冲液 2.5ul
dNTP 溶液 (每种 1.25 mmol/L) 4ul
0.1mol/LDTT 1ul
3'引物(SA2,20umol/L) 1.25ul
DEPC 处理水 11.25ul
将反应混合物 65°C 放置 5 min。
重要:为降低 RNA 中二级结构的形成,不要将反应混合物放置于冰上。
然后加入:
RNase 抑制剂 1ul
Mo-MLV 反转录酶(200 单位) 1ul
42°C 温育 90 min。
2. 同时使用寡核苷酸引物 SA2 和 SD6 进行 cDNA 第二链的有限合成。在一个无菌的薄壁离心管中混合以下试剂:
反转录反应混合物(来自步骤 1) 12.5ul
1x 扩增缓冲液 4ul
dNTP 溶液(每种 1.25 mmol/L) 6ul
引物 SA2(20umol/L) 2ul
引物 SD6(20umol/L) 2.5ul
Taq DNA 聚合酶 1~2 单位
加 DEPC 处理水至 40ul
同样处理只含载体的对照,作为一个重要的 PCR 分析对照。
3. 如热循环仪无热盖,反应混合物上方加入 1 滴(约 50ul) 的轻比重矿物油。或者按热启动 PCR 方式加入封口石蜡。将反应管放入热循环仪。
4. 按下表列出的变性、复性和延伸时间和温度进行扩增反应。

用于克隆的 cDNA 与载体的制备
5.PCR 反应产物中加入 30 单位的 BstXI, 并加入 1 滴低比重矿物油(如果在前面步骤中未加的话)。将混合后的反应管置 55°C 温浴过夜。
BstXI 酶切将大大减少空载体剪接产物以及由于载体内含子含隐蔽剪接位点而产生的假阳性。载体质粒 pSPL3 含有多个隐蔽剪接位点。由这些位点引发的异常剪接产物一般只占扩增产物中很小一部分,而且通常也只出现在空载体反应管、pSPL3 上构建的文库质量很差或者基因组 DNA 中不含通过这种方法可鉴定出的转录物。
6. 反应管中再加入 20 单位的 BstXI 并置 55BstXI 温浴 2~3 h。
7. 在进行上述步骤的同时,用 EcoR V 彻底酶切 1ug 的质粒载体 pBSⅡ(KS 或 SK)。
酚抽提并用乙醇沉淀以纯化酶切产物中的 DNA, 纯化产物用水稀释至 2ng/ul。
8. 在一个 0.5 mlPCR 扩增管中混合以下试剂:
经 BstXI 酶切后的反转录 PCR 产物(步骤 6) 5-10ul
10X 扩增缓冲液 4.5ul
dNTP(毎种 1.25 mmol/L) 7.5ul
引物 SADU(20umol/L) 2.5ul
引物 SDDU(20umol/L) 2.5ul
Taq DNA 聚合酶 10~20 单位
加 H20 至 45ul
9. 在另一个 0.5 mlPCR 扩增管中混合以下试剂:
EcoRV 酶切的 pBSⅡ(KS 或 SK)(2ng/ul) 10ul
10x 扩增缓冲液 10ul
dNTP(毎种 1.25 mmol/L) 16ul
引物 BSD-U(20umol/L) 5ul
引物 BSA-U(20umol/L) 5ul
Taq DNA 聚合酶单位 2~4 单位
加 H2O 至 100ul
10. 如热循环仪无热盖,在反应混合物(步骤 8 和 9) 中加入 1 滴(约 50ul) 的轻比重矿物油。或者按热启动 PCR 方式加入封口石蜡颗粒。将反应管放入热循环仪。
11. 按下表列出的变性、复性和延伸参数进行扩增反应。

12.1.5% 琼脂糖凝胶(TBE 配制) 电泳分析小量 PCR 产物以评价反应质量。反应产物应为典型的弥散条带(图 11-19)。

外显子捕获产物的克隆
13. 在一个 0.5 ml 的小离心管中加入下列试剂:
BstXI 酶切的 cDNA(步骤 8) 经
步骤 11 扩增反应后产物 3ul
EcoRV 酶切的 pBSⅡDNA(步骤 9) 经
步骤 11 扩增反应后产物 1ul
10x 扩增缓冲液 1ul
DNA 尿嘧啶糖基酶(UDG,1 单位/ul) 1ul
加 H2O 至 10ul
混合后置 37°C 温育 30 min。
重要:此反应中,含 dU 残基的 DNA 将被 DNA 尿嘧啶糖基酶降解,另外,带有互补末端的酶切质粒与扩増的 cDNA 将形成重组子为防止载体与 PCR 产物的非特异结合,37°C 温育后不要将反应管置于冰上。如不能立即进行步骤 14 和 15, 则将反应管继续置于 37°C 或-20°C 冻存备用。
14.CaCl2 法将全部 UDG 反应混合物转化 30~50ul DH5α菌液。
15. 取 100~500ul 的转化菌液涂布含 50ug/ml 氨苄青霉素的 LB 琼脂平板,37°C 培养过夜。
阶段 5: 克隆分析
材料
缓冲液与溶液
按合适比例稀释贮存液。
10x 扩增缓冲液
酶及缓冲液
TaqDNA 聚合酶
凝胶
琼脂糖凝胶(1.5% m/V),TAE 配制
见歩骤 7。
核酸与寡核苷酸
dNTP 溶液,四种核苷酸的浓度均为 1.25 mmol/L
克隆入载体 pBSⅡ中的外显子捕获产物
以重组 DH5a 克隆形式制备(见阶段 4)。
寡核苷酸引物 [浓度 20 mmol/L 溶于 TE(pH8.0)]

培养基
含 50ug/ml 氨苄青霉素的 LB 肉汤培养基
含 30% 甘油 (v/v) 的 LB 肉汤培养基
专用设备
PCR 用 96 孔微量滴定板
多通道加样器或加样装置(例如 Dank or Scientific 公司产品)
可放入 96 孔微滴定板的热循环仪
附加试剂
本方案歩骤 8 需要的试剂列在第 12 章,方案 3、4 或 5。
方法
1. 在 96 孔微量滴定板每孔中加入 100ul 含 50ug/ml 氨苄青霉素的 LB 肉汤培养基,并向每个孔中接入一个独立生长的转化菌克隆(来自第 4 阶段步骤 15)。用 Parafilm 封住平板,37°C 生长 3~4 h, 不需要摇动滴定板。
2. 混合下列组分制备可进行 100 个 PCR 反应的混合物:
10X 扩增缓冲液 250ul
dNTP 溶液(毎种 1.25 mmol/L) 400ul
-20 寡核苷酸引物(20 mmol/L) 125ul
REV 寡核苷酸引物(20 mmol/L) 125ul
H2O 1475ul
Taq DNA 聚合酶 75 单位
在个新的 96 孔 PCR 反应板每孔中加入 24ul 上述混合物。
3. 用 96 孔微量点样复制装置将步骤 1 滴定板中的菌液移到含反应混合物的 96 孔 PCR 反应板中。
4, 如使用的热循环仪不带热盖,在每孔反应液中加入 1 滴(约 50ul) 矿物油。也可采用类似热启动的方法,每孔中加入 1 粒固体石蜡。将 96 孔 PCR 反应板置于热循环仪中。
5. 按下表中的变性、复性及延伸时间和温度进行 PCR 扩增

6. 用多孔加样器将步骤 1 制备的菌液复制到另 1 块滴定板上,37°C 摇菌过夜,每孔中加入 100ul 含 30% 甘油的 LB 肉汤培养基,Parafilm 膜封口后-80°C 冻存。
7. 在 1.5% 琼脂糖凝胶上电泳分析步骤 5 中每孔的扩增产物。
电泳显示的扩增条带应大小不一, 根据大小是无法判断 ETP 的丰余性 (redundancy), 这是由于 PCR 产物大小集中于 120bp。
8. 确定每个 ETP 的序列(见第 12 章方案 3、4 或 5)。
克隆时使用的载体若为 PBSⅡSK-用 T7 引物测序结果为 ETP5'端起始序列。测出 ETP 序列两侧的 pSPU 序列如下:

材料
缓冲液与溶液
按合适比例稀释贮存液。
ATP(10 mmol/L)
酚:氯仿(1:1,V/V)
TE(pH8.0)
酶及缓冲液
PvuⅡ
限制性内切核酸酶
pSPL3 多克隆位点图谱见图 11-16
T4DNA 连接酶
凝胶
琼脂糖凝胶(0.9%m/V), 用 TAE 配制
见步骤 3
琼脂糖凝胶,预制
见步骤 1
核酸与寡核苷酸
黏粒载体、大肠杆菌人工染色体或酵母人工染色体 DNA, 含有靶标基因组 DNA 区域。
用于分析的重组子 DNA 纯化方法见第 4 章。
或基因组 DNA
按第 6 章提供的方法之一制备
培养基
含 50ug/ml 氨苄青霉素的 LB 琼脂平板
参见步骤 8 决定平板的合适规格。
含 50ug/ml 氨苄青霉素的 LB 肉汤培养基
SOC 培养基
专用设备
预设溫度为 15°C 和 65°C 的水浴
附加试剂
本方案步骤 8 需要的试剂列在第 1 章,方案 20。
本方案步骤 6 需要的转化所需试剂列在第 1 章,方案 23、24 或 25。
本方案步骤 10 和 12 需要的试剂列在第 1 章,方案 1 或 9。
载体与菌株
大肠杆菌菌株 HB101, 处于转化感受态
按第 1 章,方案 23,24 或 25 制备。
质粒 pSPL3
Life Technologies 公司提供单独的或作为试剂盒组分的质粒 pSPL3。
方法
1. 对 pSPL3 进行限制酶切以插入基因组 DNA(pSPL3 多克隆位点图谱见图 11-16)。对线性化的质粒 DNA 去磷酸化处理,电泳并从凝胶中回收纯化质粒。
质粒 DNA 酶切完全非常重要,产物应为大小约 6kb 的单一片段。
2. 用与上一步相同的限制酶消化 1~2ug 的基因组 DNA 或含有目的基因组 DNA 的重组质粒。
3. 用 0.9% 的琼脂糖凝胶电泳(TAE 体系)分析 10% 的基因组酶切产物。
基因组 DNA 须酶切完全而无降解。凝胶电泳分析时,注意观察有无污染细菌(或酵母)基因组 DNA, 污染的 DNA 通常呈弥傲的背景条带。
4. 将基因组 DNA 酶切体系置 65°C15 min 终止酶切反应,酚: 氯仿抽提并用标准的乙醇沉淀法回收 DNA。产物溶于 TE(pH8.0), 浓度为 100ug/ml。
5. 混合以下组分将基因组 DNA 连接到载体上:
酶切后的基因组 DNA 150ng
酶切并经去磷酸化的 PSPL3 50ng
10x 连接反应缓冲液 1ul
T4 噬菌体 DNA 连接酶 10Weiss 单位
加 H2O 至 10ul
室温温育 2~3 h 或 15°C 过夜。
10X 连接反应缓冲液组分已添加 ATP, 则反应混合物中可加入更大体积的载体或外源 DNA。使用商品化的含 ATP 的连接续冲液,则无须添加 ATP。确保引入只有载体 DNA 的对照,这对于评价构建的文库的质量非常重要。
6. 用连接反应产物转化 40ul 的 HB101 感受态细胞。
确保用阳性对照(载体 DNA) 和阴性对照(无 DNA 体系)同时转化以评价转化效率。
重要:由于在其他菌株中 pSPL3 复制不稳定,使用 HB101 作为文库和载体扩增的宿主是必须的(Churchand Buckler1999)。
7. 转化后菌液中加入 800ul 的 SOC 培养基,37°C 培养 30~45 min 使质粒编码的抗生素抗性标记基因表达。
8. 在氨苄青霉素存在下 37°C 摇菌过夜以扩增文库。
如使用单个黏粒:将 100ul 转化混合物涂布一个含 50ug/ml 氨苄青霉素的 LB 琼脂平板。剩余的加入含 50ug/ml 氨苄青霉素的 LB 肉汤液体培养基 2 ml 继续培养。
取小量转化物在 LB 平板上培养可评价转化效率。
如使用 BAC、PAC 或黏粒库:将所有转化混合物涂布在多个 50ug/ml 氨苄青霉素的 LB 琼脂平板(150 mm) 上。
这样处理是为了消除因营养竞争而导致的某些克隆的优势生长,使构建的文库更具代表性。
9. 通过比较重组子与非重组子数目估计连接效率(也就是与只有 pSPL3 的连接混合物转化 HB101 所得克隆数进行比较)。
重组子至少应达到非重组子的 500 倍到 1000 倍。
10. 如在 150 mm 平板上进行文库扩增,直接进入步骤 11。对于在液体肉汤培养基中扩增的基因组文库,用标准的碱变性法(见第 1 章,方案 1) 或质粒提取试剂盒纯化质粒,然后进入步骤 13。
11. 如整个库铺在大的 LB 琼脂平板上,则加入 10 ml 肉汤培养基浸没平板,并小心从琼脂表面将菌落刮下来,尽量减少刮入肉汤中的琼脂量。
12. 用经过修改的标准碱变性法小量质粒提取程序纯化步骤 11 中获得样品中的质粒,依次加入细菌沉淀中的试剂量调整为碱裂解液Ⅰ(300ul), 裂解液Ⅱ(600ul) 及裂解液Ⅲ(450ul)。为简化程序,在加入碱裂解液 I 后,将细菌悬液移入一个 2 ml 离心管中,这样其余程序可在此离心管中完成。在加入溶裂解液Ⅲ并离心后,将粗制的质粒上淸分为两份置于两个 1.5 ml 离心管中。用酚:氯仿及氯仿对上清进行抽提,获得的上清用异戊醇沉淀,最后合并两管中的 DNA 重悬液。也可用商品化的质粒提取试剂食完成此步(第 1 章,方案 9)。
13. 取部分纯化后的质粒 DNA 用 PvuⅡ进行酶切,通过电泳观察构建的文库质量。
PvuⅡ酶切位点靠近质粒的多克隆位点。空载体酶切产物电泳显示 4kb 和 2kb 的条带。童组克隆经切割仍可见明显的 4kb 条带,但 2kb 的条带则应很微弱或没有。2kb 条带如很明显則提示文库的质量不佳,或者 (但可能性较小)基因组 DNA 经 PvuⅡ切割成大多为 2kb 的片段(图 11-17)。如文库的质量令人满童,则可用于实验的下一步骤。

阶段 2: 电穿孔法将文库转染 COS-7 细胞
材料
缓冲液与溶液
按合适比例稀释贮存液。
无二价阳离子的磷酸缓冲液(PBS)
酶及缓冲液
胰酶-EDTA 溶液
核酸与寡核苷酸
DNA
用于转染的质粒 DNA 制备见本方案阶段 1, 步骤 10~12。
用作对照的质粒载体(步骤 3)
培养基
含 10% 热灭活胎牛血清的 Dulbecco's modified Eagle's 培养基(DMEM)
离心转头
Sorvall H1000B 转头或等同规格转头
专用设备
电穿孔转染设备以及 0.4 cm 宽的电转染槽
组织培养平皿(100 mm)
宽口加样器头
细胞与组织
COS-7 细胞
细胞须在含 10% 热灭活胎牛血清的 DMEM 培养至 75%—85% 致密。关于细胞的处理细节,包括胰酶消化,见 Spector 等(1998b)。
方法
1. 用无二价阳离子的 PBS 洗涤单层 C0S-7 细胞。通过胰酶-EDTA 处理将细胞从平皿表面消化下来。4°C、250 g(Sorvall H1000B 转头上相当于 1100r/min) 离心 10 min 回收细胞。
重要:在整个过程中须保持 COS-7 细胞处于预冷状态。
关于细胞胰酶消化细节见 Spector 等(1998b)
2. 将用于转染的 DNA 样品溶于无二价阳离子的 PBS 并调整至 100ul。
转染所需的 DNA 量应按第 16 章,方案 5 进行优化,
3. 用 700ul 无二价阳离子的 PBS 重悬 4X106COS-7 细胞。在预冷的电转染槽中混合细胞与 DNA(槽内宽 0.4 cm)。将混合物放置冰上 10 min。
PBS 体系中如含二价阳离子,将导致电转染时产生电弧,可破坏电穿孔仅。
确保应用空载体 DNA 进行电转化,作为实验对照。
4. 小心重悬细胞,按 1.2kV(3kV/cm) 和 25uF 进行电穿孔转染实验。迅速将电转槽重置于冰上,并放置 10 min。
电穿孔转染条件按第 16 章,方案 5 描述的方法进行优化。
5. 用宽口加样器头将 1x106 的电转染后的细咆转入 100 mm 的组织培养平皿中,每个平皿已加入 10 ml 预热至 37°C 的含 10% 热灭活胎牛血清的 DMEM 培养基。在设定 37°C、5%~7%CO2 及一定湿度的培养箱中培养 48~72 h。
阶段 3:mRNA 的提取
材料
缓冲液与溶液
按合适比例稀释贮存液。
DEPC 处理水
乙醇
NaCl(5mol/L)
酚
酚:氯仿
无二价阳离子的磷酸缓冲液(PBS)
SDS(5%m/V)
TMK 缓冲液
10 mmol/LTris-HCl(pH7.5)
10 mmol/LKCl
1 mmol/LMgCl2
Triton X-100(10%V/V) 或 Nonidet P-40(4%,V/V)
离心转头
Sorvall H1000B 转头或等同规格转头
专用设备
细胞刮子或橡胶刮
聚苯乙烯离心管(15 ml), 冰上预冷至 0°C
细胞与组织
分别经重组 pSPL3 和非重组 pSPL3 转染的 COS-7 细胞
方法
1. 用冰预冷的不含钙、镁离子的 PBS 洗涤平皿中的转染 COS-7 细胞三次。洗涤过程中将平皿保持在冰上。
2. 每个平皿中加入 10 ml 预冷的 PBS。保持平皿在冰上,小心的将细胞刮除下来。
3. 将细胞悬液转入预冷的 15 ml 聚苯乙烯离心管中。
使用透明的聚苯乙烯离心管,有利于步骤 8、9 中不含细胞核的胞浆的回收。
4.4°C、300 g(Sorvall H1000B 转头上相当于 1200r/min) 离心 8 min 回收细胞。
5. 尽可能倾去上清,并用加样器除去残存的上清。
6. 在 300ulTFK 缓冲液中重悬 1X106 至 2x106 的 COS 细胞,冰上放置 5 min。
7. 加入 15ul 的 10% 的 Triton X-100 或 4% 的 Nonidet P-40, 冰上放置 5 min。
加入非离子去污剂可导致质膜的轻微破解而核膜保持完整。
8.4°C、500 g(Sorvall H1000B 转头上相当于 1500r/min) 离心 5 min 沉淀细胞核。
9. 将上清移入预冷的 1.5 ml 小离心管中。
重要:移取上淸时应异常小心,切不可触及细胞核沉淀。如核膜破裂会导致基因组 DNA 污染,样品将非常黏期而难以吸取。
10. 加入 20ul 的 5%SDS 和 300ul 的酚,剧烈振荡后最大速度离心 5 min,样品将分为有机相和水相。
11. 将水相移入含 300ul 酚: 氯仿的 1.5 ml 小离心管中,剧烈振荡后室温最大速度离心 3 min 进行分相。
12. 移取上层的水相至预冷的 1.5 ml 小离心管中,加入 120 的 5mol/LNaCl 和 750ul 的乙醇。-20°C 放置 2~3 h 或-80°C 放置 30 min 以沉淀 RNA。
核酸在乙醇中比在水中更稳定。如长期保存,RNA 应置于乙醇中-80°C 冻存(见第 7 章,方案 1 结尾部分的专栏“RNA 的保存")。
13.4°C、最大速度离心 10 min 回收 RNA。
14. 弃上清并用 70% 乙醇洗涤沉淀。空气干燥后,将沉淀重悬于 20 g 的 DEPC 处理水中。
阶段 4: 反转录 PCR
材料
缓冲液与溶液
按合适比例稀释贮存液
10x 扩增缓冲液
氯仿
DEPC 处理水
DTT(lmol/L)
dNTP 溶液,每种核苷酸浓度为 1.25 mmol/L
酚
RNase 抑制剂
酶及缓冲液
Bst XI
EcoR V
Mo-MLV 反转录酶
Taq DNA 聚合酶
DNA 尿嘧啶糖基酶(1 单位/ul)

凝胶
琼脂糖凝胶(1.5%m/V), 用 TBE 配制
核酸与寡核苷酸
寡核苷酸引物 [20 mmol/L,TE(pH8.0) 配制]

分别提取自转染有对照载体和重组载体的 COS-7 细胞的 RNA(阶段 3)。
培养基
含 50ug/ml 氨苄青霉素的 LB 琼脂平板
专用设备
自动微量加样器所用的加样器尖头
微量离心管(PCR 扩增用 0.5 ml 薄壁离心管,无 RNase)
带退尖头装置的自动加样器
可设置方案中反应程序的热循环仪
如热循环仪无热盖. 使用矿物油或封口石蜡防止 PCR 反应混合物的蒸发。封□石蜡不仅可防止蒸发,还可起到在反应混合物加热之前使反应组分(如引物与模板)暂时隔铯的效果。这可防止在反应的起始阶段由于引物非特异的结合模板引发的扩增。
预设溫至 42°C、55°C 和 65°C 的水浴
附加试剂
本方案步骤 14 需要的试剂列在第 1 章,方案 25。
载体与菌株
大肠杆菌 DH5α(或其他可产生α互补的菌株)
载体 pBluescriptⅡ(KS 或 SK)(Stratagene 公司)
方法
cDNA 的合成
1. 以 SA2 寡核苷酸作为引物,用步骤 3 中获得的胞浆 RNA 作模板制备 cDNA 第一链。
在 1 个无 RNase 的 0.5 ml 离心管中混合以下试剂:
RNA 3ul
10x 圹增缓冲液 2.5ul
dNTP 溶液 (每种 1.25 mmol/L) 4ul
0.1mol/LDTT 1ul
3'引物(SA2,20umol/L) 1.25ul
DEPC 处理水 11.25ul
将反应混合物 65°C 放置 5 min。
重要:为降低 RNA 中二级结构的形成,不要将反应混合物放置于冰上。
然后加入:
RNase 抑制剂 1ul
Mo-MLV 反转录酶(200 单位) 1ul
42°C 温育 90 min。
2. 同时使用寡核苷酸引物 SA2 和 SD6 进行 cDNA 第二链的有限合成。在一个无菌的薄壁离心管中混合以下试剂:
反转录反应混合物(来自步骤 1) 12.5ul
1x 扩增缓冲液 4ul
dNTP 溶液(每种 1.25 mmol/L) 6ul
引物 SA2(20umol/L) 2ul
引物 SD6(20umol/L) 2.5ul
Taq DNA 聚合酶 1~2 单位
加 DEPC 处理水至 40ul
同样处理只含载体的对照,作为一个重要的 PCR 分析对照。
3. 如热循环仪无热盖,反应混合物上方加入 1 滴(约 50ul) 的轻比重矿物油。或者按热启动 PCR 方式加入封口石蜡。将反应管放入热循环仪。
4. 按下表列出的变性、复性和延伸时间和温度进行扩增反应。

用于克隆的 cDNA 与载体的制备
5.PCR 反应产物中加入 30 单位的 BstXI, 并加入 1 滴低比重矿物油(如果在前面步骤中未加的话)。将混合后的反应管置 55°C 温浴过夜。
BstXI 酶切将大大减少空载体剪接产物以及由于载体内含子含隐蔽剪接位点而产生的假阳性。载体质粒 pSPL3 含有多个隐蔽剪接位点。由这些位点引发的异常剪接产物一般只占扩增产物中很小一部分,而且通常也只出现在空载体反应管、pSPL3 上构建的文库质量很差或者基因组 DNA 中不含通过这种方法可鉴定出的转录物。
6. 反应管中再加入 20 单位的 BstXI 并置 55BstXI 温浴 2~3 h。
7. 在进行上述步骤的同时,用 EcoR V 彻底酶切 1ug 的质粒载体 pBSⅡ(KS 或 SK)。
酚抽提并用乙醇沉淀以纯化酶切产物中的 DNA, 纯化产物用水稀释至 2ng/ul。
8. 在一个 0.5 mlPCR 扩增管中混合以下试剂:
经 BstXI 酶切后的反转录 PCR 产物(步骤 6) 5-10ul
10X 扩增缓冲液 4.5ul
dNTP(毎种 1.25 mmol/L) 7.5ul
引物 SADU(20umol/L) 2.5ul
引物 SDDU(20umol/L) 2.5ul
Taq DNA 聚合酶 10~20 单位
加 H20 至 45ul
9. 在另一个 0.5 mlPCR 扩增管中混合以下试剂:
EcoRV 酶切的 pBSⅡ(KS 或 SK)(2ng/ul) 10ul
10x 扩增缓冲液 10ul
dNTP(毎种 1.25 mmol/L) 16ul
引物 BSD-U(20umol/L) 5ul
引物 BSA-U(20umol/L) 5ul
Taq DNA 聚合酶单位 2~4 单位
加 H2O 至 100ul
10. 如热循环仪无热盖,在反应混合物(步骤 8 和 9) 中加入 1 滴(约 50ul) 的轻比重矿物油。或者按热启动 PCR 方式加入封口石蜡颗粒。将反应管放入热循环仪。
11. 按下表列出的变性、复性和延伸参数进行扩增反应。

12.1.5% 琼脂糖凝胶(TBE 配制) 电泳分析小量 PCR 产物以评价反应质量。反应产物应为典型的弥散条带(图 11-19)。

外显子捕获产物的克隆
13. 在一个 0.5 ml 的小离心管中加入下列试剂:
BstXI 酶切的 cDNA(步骤 8) 经
步骤 11 扩增反应后产物 3ul
EcoRV 酶切的 pBSⅡDNA(步骤 9) 经
步骤 11 扩增反应后产物 1ul
10x 扩增缓冲液 1ul
DNA 尿嘧啶糖基酶(UDG,1 单位/ul) 1ul
加 H2O 至 10ul
混合后置 37°C 温育 30 min。
重要:此反应中,含 dU 残基的 DNA 将被 DNA 尿嘧啶糖基酶降解,另外,带有互补末端的酶切质粒与扩増的 cDNA 将形成重组子为防止载体与 PCR 产物的非特异结合,37°C 温育后不要将反应管置于冰上。如不能立即进行步骤 14 和 15, 则将反应管继续置于 37°C 或-20°C 冻存备用。
14.CaCl2 法将全部 UDG 反应混合物转化 30~50ul DH5α菌液。
15. 取 100~500ul 的转化菌液涂布含 50ug/ml 氨苄青霉素的 LB 琼脂平板,37°C 培养过夜。
阶段 5: 克隆分析
材料
缓冲液与溶液
按合适比例稀释贮存液。
10x 扩增缓冲液
酶及缓冲液
TaqDNA 聚合酶
凝胶
琼脂糖凝胶(1.5% m/V),TAE 配制
见歩骤 7。
核酸与寡核苷酸
dNTP 溶液,四种核苷酸的浓度均为 1.25 mmol/L
克隆入载体 pBSⅡ中的外显子捕获产物
以重组 DH5a 克隆形式制备(见阶段 4)。
寡核苷酸引物 [浓度 20 mmol/L 溶于 TE(pH8.0)]

培养基
含 50ug/ml 氨苄青霉素的 LB 肉汤培养基
含 30% 甘油 (v/v) 的 LB 肉汤培养基
专用设备
PCR 用 96 孔微量滴定板
多通道加样器或加样装置(例如 Dank or Scientific 公司产品)
可放入 96 孔微滴定板的热循环仪
附加试剂
本方案歩骤 8 需要的试剂列在第 12 章,方案 3、4 或 5。
方法
1. 在 96 孔微量滴定板每孔中加入 100ul 含 50ug/ml 氨苄青霉素的 LB 肉汤培养基,并向每个孔中接入一个独立生长的转化菌克隆(来自第 4 阶段步骤 15)。用 Parafilm 封住平板,37°C 生长 3~4 h, 不需要摇动滴定板。
2. 混合下列组分制备可进行 100 个 PCR 反应的混合物:
10X 扩增缓冲液 250ul
dNTP 溶液(毎种 1.25 mmol/L) 400ul
-20 寡核苷酸引物(20 mmol/L) 125ul
REV 寡核苷酸引物(20 mmol/L) 125ul
H2O 1475ul
Taq DNA 聚合酶 75 单位
在个新的 96 孔 PCR 反应板每孔中加入 24ul 上述混合物。
3. 用 96 孔微量点样复制装置将步骤 1 滴定板中的菌液移到含反应混合物的 96 孔 PCR 反应板中。
4, 如使用的热循环仪不带热盖,在每孔反应液中加入 1 滴(约 50ul) 矿物油。也可采用类似热启动的方法,每孔中加入 1 粒固体石蜡。将 96 孔 PCR 反应板置于热循环仪中。
5. 按下表中的变性、复性及延伸时间和温度进行 PCR 扩增

6. 用多孔加样器将步骤 1 制备的菌液复制到另 1 块滴定板上,37°C 摇菌过夜,每孔中加入 100ul 含 30% 甘油的 LB 肉汤培养基,Parafilm 膜封口后-80°C 冻存。
7. 在 1.5% 琼脂糖凝胶上电泳分析步骤 5 中每孔的扩增产物。
电泳显示的扩增条带应大小不一, 根据大小是无法判断 ETP 的丰余性 (redundancy), 这是由于 PCR 产物大小集中于 120bp。
8. 确定每个 ETP 的序列(见第 12 章方案 3、4 或 5)。
克隆时使用的载体若为 PBSⅡSK-用 T7 引物测序结果为 ETP5'端起始序列。测出 ETP 序列两侧的 pSPU 序列如下:






