用 T7 噬菌体 DNA 聚合酶进行双脱氧测序反应实验
材料与仪器去离子蒸馏水 二硫苏糖醇 dNTP 和 ddNTP 标记混合液和 ddNTP 延伸 终止混合液 甲酰胺上样缓冲液 测序酶稀释缓冲液 测序酶反应缓冲液含
材料与仪器
去离子蒸馏水 二硫苏糖醇 dNTP 和 ddNTP 标记混合液和 ddNTP 延伸 终止混合液 甲酰胺上样缓冲液 测序酶稀释缓冲液 测序酶反应缓冲液含MgCl2 测序酶 酵母无机焦磷酸酶 寡核苷酸引物 模板 DNA 放射性化合物
离心机和转头 微量离心管或微量滴定板
离心机和转头 微量离心管或微量滴定板
步骤
材料
缓充液和溶液
去离子蒸馏水(冰预冷)
二硫苏糖醇(DTT)(100 mmol/L)
dNTP 和 ddNTP,dNTP(0.5 mmol/L) 和 ddNTP(0.5 mmol/L) 储液
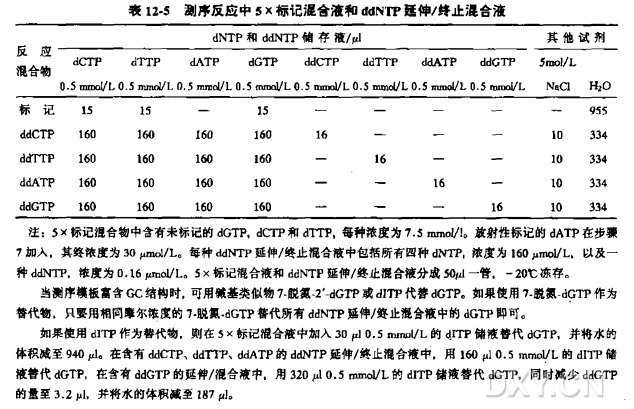
5X 标记混合液和 ddNTP 延伸/终止混合液(ddCTP、ddTTP、ddATP、ddGTP)
这些反应混合液可按表 12-5 给出的溶液体积混合配制。
甲酰胺上样缓冲液
测序酶稀释缓冲液
10 mmol/L Tris-Cl(pH7.5)
5 mmol/L DTT
0.5 mg/ml 牛血淸白蛋白
-20°C 储存
5X 测序酶反应缓冲液,含 MgCl2
200 mmol/LTris-Cl(pH7.5)
100 mmol/L
125 mmol/LNaCl
-20°C 储存
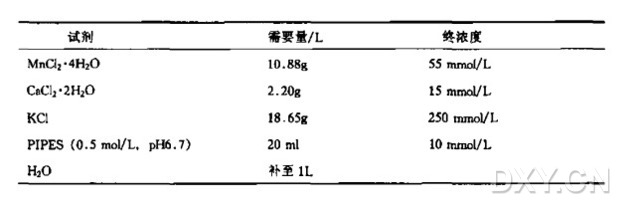
5x 测序酶反应缓冲液,含 MnCl2
200 mmol/LTris-Cl(pH7.5)
25 mmol/LMnCl2
125 mmol/LNaCl
-20°C 贮存
在测序酶反应缓冲液中含有 Mn2+可以增加测序酶利用 ddNTP 的效率,即使有 Mg2+存在也是如此 (TaborandRichardsonlSS%)。结果使在测序反应中靠近引物部分产生有效终止,进而增强靠近寡核苷酸引物处条带的强度,或者当使用 dITP 碱基类似物时,有利于消除富含 GC 区序列的影响。
为了使用 Mn2+,可在加入测序之前在标记反应中加入 1ul 含有 MnCl2 的 5x 测序酶反应缓冲掖 (Fuller et al.1996) 或者加入 0.01 体积的 1mol/L MnCI2 至双脱氧-dNTP 廷伸/终止混合液中(Kristmse et al.1990)。含锰的缓冲液如呈淡黄色或产生黄褐色沉淀将不能使用。
TE(pH7.6)
酶和缓冲液
测序酶(2.0 版)
测序酶由生产商提供,浓度为 13u/ul(约 lmg/ml)。-20°C 储存(不要使用无霜冰箱)。
酵母无机焦磷酸酶
可选用,请参见步驟 6。厂商(USB/Amersham Life Science 公司)提供的酶浓度为 5u/ml,它可催化焦磷酸水解为 2 分子正磷酸盐。
焦磷酸酶与测序酶以 1:3 的比例混合,最好采用等体积混合两种酶,并用 6 倍体积的酶稀释缓冲液稀释该混合钧。测序酶的工作浓度为 1.6u/ul, 同时加入足量焦磷酸酶以防止焦磷酸的积累,每个测序反应需 2ul 稀释的酶混合液。
核酸和寡梭苷酸
寡核苷酸引物
浓度为 0.5pmol/ul(约 3.3ng/ul), 溶于水或 TE(pH7.6) 中。
请参见信息栏"DNA 测序寡核苷酸引物储液制备”。对于一些结合于靶区域上游载体序列的通用引物, 可参见第 8 章信息栏“通用引物”。
模板 DNA(lug/ul) 溶于 TE(PH7.6) 中
每一套测序反应需要 1ug 单链 DNA 或 2.0ug 变性双链质粒 DNA。双链线性 DNA 需要变性,并使它与引物复性。即先把天然模板 DNA 与过量的引物混合,在沸水浴中加热约 2 min, 然后把试管插入冰水浴中。不要让混合液溫度回升,立刻使用。
小规模制备 M13 噬菌体重组于单链 DNA 的浓度一般在 0.05-0.5ug/ml 的范围内。这取决于特定噬菌体的生长速度。在正常测序反应条件下,模板 DNA 是过量的。因而毎次测序反应中模板量上的微小变化并不影响测序结果的质量。可参见本方案末尾的表 12-6。
放射性化合物
[a-35S]dATF(1000Ci/mmol,10mCi/ml) 或
[a-33P]dATP(1000~3000Ci/mml, 约 20mCi/ml) 或
[a-32P]dATP(1000Ci/mmol,10mCi/ml)
若不用放射性标记的 [32P]dATP 作为内标记,也可以用 5'端以 35P 标记的寡核苷酸引物进行测序反应,此时可用 2ul 放射性标记引物(约 5X105cpm; 约 0.5ng) 和 2ul 水代替反应中的未标记引物(步骤 1) 和放射性标记 dATP(步骤 7), 其他步骤相同。一般用多核苷酸激酶催化 ATP 的 [γ-32P] 转移至寡核苷酸 5‘末端。详细步骤见第 10 章的方案 2。
离心机和转头
离心转头或用于 0.5 ml 微量离心管的衔接头,以及甩平式转头和微量滴定板架 (如 Sorvall 公司产品),聚苯乙烯泡沬或橡胶衬垫。
专用设备
微量离心管(0.5 ml)或微量滴定板(柔韧,耐热,每孔容量约为 300ul 的 U 型底 96 孔板)
参见信息栏“微量滴定板”。
可加热到 37°C 和 65°C 的水浴或加热板。
方法
重要:当测序的双链质粒 DNA 已经变性,并已与引物退火(方案 2), 可以忽略本方案的前两步. 直接从步骤 3 开始。
1. 在 0.5 ml 微量离心管或微量滴定板孔中加入:
单链模板 DNA(1ug/ul) 1ul
寡核苷敢引物(约 1ng/ul) 3ul
5X 测序酶反应缓冲液 2ul
含 MgCl2 或 MnCl2
水 至终体积 10ul
2. 封闭试管,在 65°C 温育 2 min,然后取出离心管,使之在 3~5 min 内冷却至室温。
有些实验人员喜欢用小加热板或装水的烧杯,使该退火反应在 30 min 的过程中缓慢冷却。我们实验中发现,这两种方法的实验结果相同。
3. 在引物和模板降温时,融化 5X 标记混合液、ddNTP 延伸/终止混合液和放射性标记的 dATP,融化后置于冰上。若有必要,退火的棋板和引物可在-20°C 下保藏几个月。
4. 取 2.5ul 每种 ddNTP 延伸/终止反应混合液加至用彩色标记或用字母 C、T、A、G 标记的各个 0.5 ml 微量心管或微量滴定板各孔中。
当液滴挂在离心管壁或微量滴定板孔壁时. 应离心使之沉入底部。
5. 将 5x 标记混合液用冰预冷的水稀释 5 倍,每种测序反应需要 2ul 稀释的标记混合液。
6. 用冰预冷的测序酶稀释缓冲液稀释测序酶,如材料中所述可加,也可不加酵母焦磷酸酶。
毎种模板测序需要测序酶(含 3 单位)。测序酶要始终放置于冰上。

7. 为进行标记反应,在步骤 2 的 10ul 退火反应液中加入如下溶液:
稀释的标记混合液(来自步骤 5) 2ul
0.1mol/L 二硫苏糖醇 1ul
[a-33P]dATP,[a-32P]dATP 或 [a-35S]dATP 0.5ul
稀释的测序酶(约 1.6u/ul) 2.0ul
轻轻拍打离心管壁或滴定板以便混匀反应物,然后在 20°C 孵育 2~5 min。
稀释的测序时应保存在冰上,不要使其温度升至室温。供应商提供的浓缩酶应贮存于-20°C, 如果置于冰上几小时酶将失活。
8. 在标记反应将近完成时,应于 37°C 预热离心管或微量滴定板以便进行终止反应。这—步很重要。然后,转移 3.5ul 标记反应液到已经预热的、做好标记的、已加入适量的双脱氧混合液(上述步骤 4) 的微量离心管壁或微量滴定板孔壁上。
9. 在室温下,将微量离心管放入微量离心机中(用适合于 0.5 ml 离心管的转头或衔接头,或将其置于去盖的 1.5 ml 离心管中),或将微量滴定板置于有适当衔接头的离心机中,以 2000r/min 离心 C、T、A、G 管或板几秒钟,混匀混合液。然后立即将反应物置于 37°C 加热板或水浴中 3~5 min。
10. 加 4ul 甲酰胺上样缓冲液终止反应。
11. 这些反应物在-20°C 时可最多保存 5 天,也可以用变性凝胶电泳直接分析(见方案 8、9、或 10、11 和 12)。热变性后(100°C,2 min), 在冰上快速冷却。取 C、T、A 和 G 反应物各 3ul 加入测序凝胶的各孔中。




缓充液和溶液
去离子蒸馏水(冰预冷)
二硫苏糖醇(DTT)(100 mmol/L)
dNTP 和 ddNTP,dNTP(0.5 mmol/L) 和 ddNTP(0.5 mmol/L) 储液
5X 标记混合液和 ddNTP 延伸/终止混合液(ddCTP、ddTTP、ddATP、ddGTP)
这些反应混合液可按表 12-5 给出的溶液体积混合配制。
甲酰胺上样缓冲液
测序酶稀释缓冲液
10 mmol/L Tris-Cl(pH7.5)
5 mmol/L DTT
0.5 mg/ml 牛血淸白蛋白
-20°C 储存
5X 测序酶反应缓冲液,含 MgCl2
200 mmol/LTris-Cl(pH7.5)
100 mmol/L
125 mmol/LNaCl
-20°C 储存

5x 测序酶反应缓冲液,含 MnCl2
200 mmol/LTris-Cl(pH7.5)
25 mmol/LMnCl2
125 mmol/LNaCl
-20°C 贮存
在测序酶反应缓冲液中含有 Mn2+可以增加测序酶利用 ddNTP 的效率,即使有 Mg2+存在也是如此 (TaborandRichardsonlSS%)。结果使在测序反应中靠近引物部分产生有效终止,进而增强靠近寡核苷酸引物处条带的强度,或者当使用 dITP 碱基类似物时,有利于消除富含 GC 区序列的影响。
为了使用 Mn2+,可在加入测序之前在标记反应中加入 1ul 含有 MnCl2 的 5x 测序酶反应缓冲掖 (Fuller et al.1996) 或者加入 0.01 体积的 1mol/L MnCI2 至双脱氧-dNTP 廷伸/终止混合液中(Kristmse et al.1990)。含锰的缓冲液如呈淡黄色或产生黄褐色沉淀将不能使用。
TE(pH7.6)
酶和缓冲液
测序酶(2.0 版)
测序酶由生产商提供,浓度为 13u/ul(约 lmg/ml)。-20°C 储存(不要使用无霜冰箱)。
酵母无机焦磷酸酶
可选用,请参见步驟 6。厂商(USB/Amersham Life Science 公司)提供的酶浓度为 5u/ml,它可催化焦磷酸水解为 2 分子正磷酸盐。
焦磷酸酶与测序酶以 1:3 的比例混合,最好采用等体积混合两种酶,并用 6 倍体积的酶稀释缓冲液稀释该混合钧。测序酶的工作浓度为 1.6u/ul, 同时加入足量焦磷酸酶以防止焦磷酸的积累,每个测序反应需 2ul 稀释的酶混合液。
核酸和寡梭苷酸
寡核苷酸引物
浓度为 0.5pmol/ul(约 3.3ng/ul), 溶于水或 TE(pH7.6) 中。
请参见信息栏"DNA 测序寡核苷酸引物储液制备”。对于一些结合于靶区域上游载体序列的通用引物, 可参见第 8 章信息栏“通用引物”。
模板 DNA(lug/ul) 溶于 TE(PH7.6) 中
每一套测序反应需要 1ug 单链 DNA 或 2.0ug 变性双链质粒 DNA。双链线性 DNA 需要变性,并使它与引物复性。即先把天然模板 DNA 与过量的引物混合,在沸水浴中加热约 2 min, 然后把试管插入冰水浴中。不要让混合液溫度回升,立刻使用。
小规模制备 M13 噬菌体重组于单链 DNA 的浓度一般在 0.05-0.5ug/ml 的范围内。这取决于特定噬菌体的生长速度。在正常测序反应条件下,模板 DNA 是过量的。因而毎次测序反应中模板量上的微小变化并不影响测序结果的质量。可参见本方案末尾的表 12-6。
放射性化合物
[a-35S]dATF(1000Ci/mmol,10mCi/ml) 或
[a-33P]dATP(1000~3000Ci/mml, 约 20mCi/ml) 或
[a-32P]dATP(1000Ci/mmol,10mCi/ml)
若不用放射性标记的 [32P]dATP 作为内标记,也可以用 5'端以 35P 标记的寡核苷酸引物进行测序反应,此时可用 2ul 放射性标记引物(约 5X105cpm; 约 0.5ng) 和 2ul 水代替反应中的未标记引物(步骤 1) 和放射性标记 dATP(步骤 7), 其他步骤相同。一般用多核苷酸激酶催化 ATP 的 [γ-32P] 转移至寡核苷酸 5‘末端。详细步骤见第 10 章的方案 2。
离心机和转头
离心转头或用于 0.5 ml 微量离心管的衔接头,以及甩平式转头和微量滴定板架 (如 Sorvall 公司产品),聚苯乙烯泡沬或橡胶衬垫。
专用设备
微量离心管(0.5 ml)或微量滴定板(柔韧,耐热,每孔容量约为 300ul 的 U 型底 96 孔板)
参见信息栏“微量滴定板”。
可加热到 37°C 和 65°C 的水浴或加热板。
方法
重要:当测序的双链质粒 DNA 已经变性,并已与引物退火(方案 2), 可以忽略本方案的前两步. 直接从步骤 3 开始。
1. 在 0.5 ml 微量离心管或微量滴定板孔中加入:
单链模板 DNA(1ug/ul) 1ul
寡核苷敢引物(约 1ng/ul) 3ul
5X 测序酶反应缓冲液 2ul
含 MgCl2 或 MnCl2
水 至终体积 10ul
2. 封闭试管,在 65°C 温育 2 min,然后取出离心管,使之在 3~5 min 内冷却至室温。
有些实验人员喜欢用小加热板或装水的烧杯,使该退火反应在 30 min 的过程中缓慢冷却。我们实验中发现,这两种方法的实验结果相同。
3. 在引物和模板降温时,融化 5X 标记混合液、ddNTP 延伸/终止混合液和放射性标记的 dATP,融化后置于冰上。若有必要,退火的棋板和引物可在-20°C 下保藏几个月。
4. 取 2.5ul 每种 ddNTP 延伸/终止反应混合液加至用彩色标记或用字母 C、T、A、G 标记的各个 0.5 ml 微量心管或微量滴定板各孔中。
当液滴挂在离心管壁或微量滴定板孔壁时. 应离心使之沉入底部。
5. 将 5x 标记混合液用冰预冷的水稀释 5 倍,每种测序反应需要 2ul 稀释的标记混合液。
6. 用冰预冷的测序酶稀释缓冲液稀释测序酶,如材料中所述可加,也可不加酵母焦磷酸酶。
毎种模板测序需要测序酶(含 3 单位)。测序酶要始终放置于冰上。

7. 为进行标记反应,在步骤 2 的 10ul 退火反应液中加入如下溶液:
稀释的标记混合液(来自步骤 5) 2ul
0.1mol/L 二硫苏糖醇 1ul
[a-33P]dATP,[a-32P]dATP 或 [a-35S]dATP 0.5ul
稀释的测序酶(约 1.6u/ul) 2.0ul
轻轻拍打离心管壁或滴定板以便混匀反应物,然后在 20°C 孵育 2~5 min。
稀释的测序时应保存在冰上,不要使其温度升至室温。供应商提供的浓缩酶应贮存于-20°C, 如果置于冰上几小时酶将失活。
8. 在标记反应将近完成时,应于 37°C 预热离心管或微量滴定板以便进行终止反应。这—步很重要。然后,转移 3.5ul 标记反应液到已经预热的、做好标记的、已加入适量的双脱氧混合液(上述步骤 4) 的微量离心管壁或微量滴定板孔壁上。
9. 在室温下,将微量离心管放入微量离心机中(用适合于 0.5 ml 离心管的转头或衔接头,或将其置于去盖的 1.5 ml 离心管中),或将微量滴定板置于有适当衔接头的离心机中,以 2000r/min 离心 C、T、A、G 管或板几秒钟,混匀混合液。然后立即将反应物置于 37°C 加热板或水浴中 3~5 min。
10. 加 4ul 甲酰胺上样缓冲液终止反应。
11. 这些反应物在-20°C 时可最多保存 5 天,也可以用变性凝胶电泳直接分析(见方案 8、9、或 10、11 和 12)。热变性后(100°C,2 min), 在冰上快速冷却。取 C、T、A 和 G 反应物各 3ul 加入测序凝胶的各孔中。