制备和转化感受态大肠杆菌的Inoue方法实验(制备超级感受态细胞)
原理采用 Inoue 的方法(1990)制备大肠杆菌感受态细胞很好时甚至能达到 Hanahan 方法(1980)的转化效率。但在标准的实验室条件下,达到 1X1
原理
采用 Inoue 的方法(1990)制备大肠杆菌感受态细胞很好时甚至能达到 Hanahan 方法(1980)的转化效率。但在标准的实验室条件下,达到 1X108~3X108 个转化克隆/ μg 质粒 DNA 的转化效率更为常见。与 Hanahan 方法相比,这一方法的优点在于并不过分地讲究细节,但是重复性更好,而且更有预见性。
材料与仪器
质粒 DNA
二甲亚砜 DMSO Inoue 转化缓冲液
SOB 琼脂板 SOC 培养基 Sorvall GSA 转头或与之相当的转头 液氮 聚丙烯离心管 水浴
二甲亚砜 DMSO Inoue 转化缓冲液
SOB 琼脂板 SOC 培养基 Sorvall GSA 转头或与之相当的转头 液氮 聚丙烯离心管 水浴
步骤
一、材料
1. 缓冲液和溶液
(1) 二甲亚砜 DMSO
二甲亚砜的氧化产物据推测为二甲硫醚,是转化的抑制物(Hanahan 1985)。为避免上述问题,应购买高质量的 DMSO。
(2) Inoue 转化缓冲液
用前置于冰上预冷至 0℃。
2. 核酸和寡核苷酸
质粒 DNA ( 重组质粒)
3. 培养基
(1) LB 或 SOB 培养基(培养最初的细菌生长物)
(2) SOB 琼脂板,含 20 mmol/L MgSO4 和适当的抗生素。
标准的 SOB 琼脂板含 10 mmol/L MgSO4。
(3) SOB 培养基(培养转化的细菌)
培养前,准备 3 个内盛 250 ml 18~20 ℃ SOB 的1 L 锥形瓶。
(4) SOC 培养液
每个转化反应约需 1 ml。
4. 离心机和转头
Sorvall GSA 转头或与之相当的转头
5. 专用设备
液氮,聚丙烯管,18℃ 摇床,温度可调 42℃ 的水浴装置。
二、方法
1. 制备感受态细胞
(1) 准备 Inoue 转化缓冲液(用前冰上预冷)。
① 0.5 mol/L 的 PIPES ( pH 6.7) [ 哌嗪-N, N'-双(2-乙磺酸)] 溶液的配制:将 15.1 g PIPES 溶于 80 ml 水中(Milli-Q 级,或与之相当级别的 ),用 5 mol/L KOH 调 pH 值至 6.7,最后加纯水,定容至 100 ml。用预先处理的 Nalgene 滤膜 ( 0.45 μm 孔径)过滤除菌。分成小份于 -20℃ 保存。
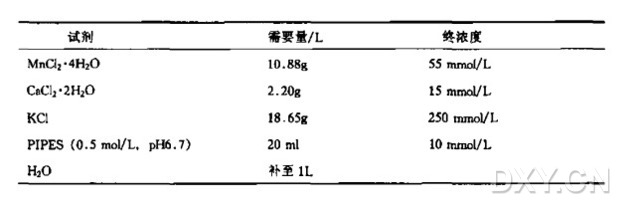
② Inoue 转化缓冲液的配制:将下列组分溶于 800 ml 纯水中,然后加 20 ml 0.5 mol/ L PIPES ( pH 6.7),然后加 20 ml 0.5 mol/L 的 PIPES (pH 6.7),加纯水定容至 1 L。
③ 用预先处理的 Nalgene 滤膜(0.45 μm 孔径)过滤除菌。分成小份于 -20℃ 保存。
(2) 挑取一个经 37℃ 培养 16~20 h 平皿上的单菌落 ( 2~3 mm 直径),接种至 250 ml 锥形瓶中的 25 ml LB 培养液或 SOB 培养液中,37℃ 摇床 ( 250~300 r/min) 培养 6~8 h。
(3) 晚上约 6 点钟,将上述初始培养物接种于三个盛有 250 ml SOB 培养液的 1L 锥形瓶 中,第一个加 10 ml, 第二个加 4 ml, 第三个加 2 ml, 于 18~22℃ 中速摇床过夜。
(4) 次日早上,测量三瓶培养物的 OD600 值,每 45 min 测定一次。
(5) 当有一瓶的培养物 OD600 = 0.55 时,将培养瓶置于冰上 10 min, 弃去另两瓶培养物。
由于大多数实验室的昼夜温差较大,而且温差也随一年四季及工作人员数的变化而变化。因此,很难预测合适 OD 值的时期,尤其是晚上同时培养三瓶不同浓度梯度的菌液,可以提高成功的机会,培养过夜的菌液至少有一瓶是符合要求的。
(6) 于 4℃ 以 2500 g ( 相当于 Sorall GSA 转头,900 r/min) 离心 10 min 收集菌体。
(7) 倒去培养液,将离心管倒扣在吸水纸上 2 min 以吸干剩余液体,用一个真空吸引器将贴附在管壁上的培养基吸干。
(8) 加 80 ml 预冷的 Inoue 转化缓冲液重悬细菌沉淀。
轻轻旋转,不要用振荡器或吹吸混匀。
(9) 于 4℃ 2500 g ( 相当于 Sorall GSA 转头 3900 r/min) 离心 10 min 收集菌体。
(10) 倒去上层培养液,将离心管倒扣在吸水纸上 2 min 以吸干剩余液体,用一个真空吸引器将附在管壁上的培养基吸干。
2. 冻存感受态细胞
(1) 用 20 ml 预冷的 Inoue 转化缓冲液轻轻重悬沉淀。
(2) 加 1.5 ml DMSO。轻轻混匀细菌悬液,放置冰上 10 min。
(3) 迅速将悬液分装到冷却的无菌微量离心管中,封紧管口,没入液氮中快速冰冻感受态细胞。贮存于 -70℃ 备用。
(4) 需要时冰箱中取出一管感受态细胞,把管握于手心,融化细胞。细胞一经融化,立即把管转移至冰浴中,在冰上放置 10 min。
(5) 用一冷的无菌吸头把感受态细胞转移到冷却的无菌聚丙烯管(17X 170 mm) 中,放置在冰浴上。
不用玻璃管是因为它们会降低转化效率约 10 倍。
3. 转化
包括阳性和阴性对照。
(1) 将要转化的 DNA 片段加入到装有感受态细胞的管中(50 μl 感受态细胞需 25 ng DNA), 体积不应超过感受态细胞的 5%,轻轻旋转几次混匀内容物。实验中至少设对照管:一个含有感受态细胞和已知量的超螺旋质粒 DNA,另一管只有感受态细胞。混匀内容物,冰浴 30 min。
(2) 将管放入预加温至 42℃ 的循环水浴中,恰恰放置 90 s,不要摇动。
热激是一个关键步骤,准确地达到热激温度非常重要。这里的温度及温育的时间都是使用 Falcon 2059 管 的测量参数,其他类型的管将可能获得不同的结果。
(3) 快速将管转移到冰浴中,使细胞冷却 1~2 min。
(4) 每管加 800 μl SOC 培养基,用水浴将培养基加温至 37℃,然后将管转移到设置为 37℃ 的摇床上,温育 45 min,使细菌复苏并表达质粒编码的抗生素抗性标记基因。
为最大限度地提高转化率,复苏期中应温和地摇动细胞(< 225 r/min)。
如果带有 α 互补,请接 “ 用 X-gal 和 IPTG 筛选细菌菌落:α 互补”。
(17) 将适当体积(每个 90 mm 平板达 200 μl ) 已转化的感受态细胞转移到含 20 mmol/L MgSO4 和相应抗生素的 SOB 培养基上。
如果用四环素作为选择标记,全部的转化混合物可以铺在一个单独的平皿上(或软琼脂中),可以先在微量离心机上室温离心 20 s以收集转化菌,在轻拍管壁的同时加入 100 μl SOC 重悬沉淀。
重要:玻璃铺菌器先需在乙醇中浸泡,然后在酒精灯上灼烧,待它凉至室温后,才可将转化菌轻轻地铺在琼脂板表面。
如检査氨芐青霉素的抗性,用转化菌铺平板时密度应较低(每个 90 mm 平板不超过 104 菌落 ),于 37℃ 培养的时间不超过 20 h。氰苄青霉素抗性的转化体可将β-内酰胺酶分泌到培养基中,迅速灭活菌落周围区域的青霉素。这样,铺平板时密度过高或培养时间过长都会导致出现对氰苄青霉索敏感的卫星菌落。在选择培养基中不用氨苄青霉素而用羧苄青霉素,以及将抗生素浓度从60 μg/ml 提高到 100 μg/ml,可使情况有所改善,但不能彻底根除之。抗氨芐青霉素菌落的增加与平皿上所加的细菌数的增加并无线性比例关系,这可能是因为被抗生素杀死的细胞释放生长抑制物质的缘故。
(18) 将平板置于室温直至液体被吸收。
(19) 倒置平皿,于 37℃ 培养,12~16 h 后可出现菌落。
1. 缓冲液和溶液
(1) 二甲亚砜 DMSO
二甲亚砜的氧化产物据推测为二甲硫醚,是转化的抑制物(Hanahan 1985)。为避免上述问题,应购买高质量的 DMSO。
(2) Inoue 转化缓冲液
用前置于冰上预冷至 0℃。
2. 核酸和寡核苷酸
质粒 DNA ( 重组质粒)
3. 培养基
(1) LB 或 SOB 培养基(培养最初的细菌生长物)
(2) SOB 琼脂板,含 20 mmol/L MgSO4 和适当的抗生素。
标准的 SOB 琼脂板含 10 mmol/L MgSO4。
(3) SOB 培养基(培养转化的细菌)
培养前,准备 3 个内盛 250 ml 18~20 ℃ SOB 的1 L 锥形瓶。
(4) SOC 培养液
每个转化反应约需 1 ml。
4. 离心机和转头
Sorvall GSA 转头或与之相当的转头
5. 专用设备
液氮,聚丙烯管,18℃ 摇床,温度可调 42℃ 的水浴装置。
二、方法
1. 制备感受态细胞
(1) 准备 Inoue 转化缓冲液(用前冰上预冷)。
① 0.5 mol/L 的 PIPES ( pH 6.7) [ 哌嗪-N, N'-双(2-乙磺酸)] 溶液的配制:将 15.1 g PIPES 溶于 80 ml 水中(Milli-Q 级,或与之相当级别的 ),用 5 mol/L KOH 调 pH 值至 6.7,最后加纯水,定容至 100 ml。用预先处理的 Nalgene 滤膜 ( 0.45 μm 孔径)过滤除菌。分成小份于 -20℃ 保存。
② Inoue 转化缓冲液的配制:将下列组分溶于 800 ml 纯水中,然后加 20 ml 0.5 mol/ L PIPES ( pH 6.7),然后加 20 ml 0.5 mol/L 的 PIPES (pH 6.7),加纯水定容至 1 L。

③ 用预先处理的 Nalgene 滤膜(0.45 μm 孔径)过滤除菌。分成小份于 -20℃ 保存。
(2) 挑取一个经 37℃ 培养 16~20 h 平皿上的单菌落 ( 2~3 mm 直径),接种至 250 ml 锥形瓶中的 25 ml LB 培养液或 SOB 培养液中,37℃ 摇床 ( 250~300 r/min) 培养 6~8 h。
(3) 晚上约 6 点钟,将上述初始培养物接种于三个盛有 250 ml SOB 培养液的 1L 锥形瓶 中,第一个加 10 ml, 第二个加 4 ml, 第三个加 2 ml, 于 18~22℃ 中速摇床过夜。
(4) 次日早上,测量三瓶培养物的 OD600 值,每 45 min 测定一次。
(5) 当有一瓶的培养物 OD600 = 0.55 时,将培养瓶置于冰上 10 min, 弃去另两瓶培养物。
由于大多数实验室的昼夜温差较大,而且温差也随一年四季及工作人员数的变化而变化。因此,很难预测合适 OD 值的时期,尤其是晚上同时培养三瓶不同浓度梯度的菌液,可以提高成功的机会,培养过夜的菌液至少有一瓶是符合要求的。
(6) 于 4℃ 以 2500 g ( 相当于 Sorall GSA 转头,900 r/min) 离心 10 min 收集菌体。
(7) 倒去培养液,将离心管倒扣在吸水纸上 2 min 以吸干剩余液体,用一个真空吸引器将贴附在管壁上的培养基吸干。
(8) 加 80 ml 预冷的 Inoue 转化缓冲液重悬细菌沉淀。
轻轻旋转,不要用振荡器或吹吸混匀。
(9) 于 4℃ 2500 g ( 相当于 Sorall GSA 转头 3900 r/min) 离心 10 min 收集菌体。
(10) 倒去上层培养液,将离心管倒扣在吸水纸上 2 min 以吸干剩余液体,用一个真空吸引器将附在管壁上的培养基吸干。
2. 冻存感受态细胞
(1) 用 20 ml 预冷的 Inoue 转化缓冲液轻轻重悬沉淀。
(2) 加 1.5 ml DMSO。轻轻混匀细菌悬液,放置冰上 10 min。
(3) 迅速将悬液分装到冷却的无菌微量离心管中,封紧管口,没入液氮中快速冰冻感受态细胞。贮存于 -70℃ 备用。
(4) 需要时冰箱中取出一管感受态细胞,把管握于手心,融化细胞。细胞一经融化,立即把管转移至冰浴中,在冰上放置 10 min。
(5) 用一冷的无菌吸头把感受态细胞转移到冷却的无菌聚丙烯管(17X 170 mm) 中,放置在冰浴上。
不用玻璃管是因为它们会降低转化效率约 10 倍。
3. 转化
包括阳性和阴性对照。
(1) 将要转化的 DNA 片段加入到装有感受态细胞的管中(50 μl 感受态细胞需 25 ng DNA), 体积不应超过感受态细胞的 5%,轻轻旋转几次混匀内容物。实验中至少设对照管:一个含有感受态细胞和已知量的超螺旋质粒 DNA,另一管只有感受态细胞。混匀内容物,冰浴 30 min。
(2) 将管放入预加温至 42℃ 的循环水浴中,恰恰放置 90 s,不要摇动。
热激是一个关键步骤,准确地达到热激温度非常重要。这里的温度及温育的时间都是使用 Falcon 2059 管 的测量参数,其他类型的管将可能获得不同的结果。
(3) 快速将管转移到冰浴中,使细胞冷却 1~2 min。
(4) 每管加 800 μl SOC 培养基,用水浴将培养基加温至 37℃,然后将管转移到设置为 37℃ 的摇床上,温育 45 min,使细菌复苏并表达质粒编码的抗生素抗性标记基因。
为最大限度地提高转化率,复苏期中应温和地摇动细胞(< 225 r/min)。
如果带有 α 互补,请接 “ 用 X-gal 和 IPTG 筛选细菌菌落:α 互补”。
(17) 将适当体积(每个 90 mm 平板达 200 μl ) 已转化的感受态细胞转移到含 20 mmol/L MgSO4 和相应抗生素的 SOB 培养基上。
如果用四环素作为选择标记,全部的转化混合物可以铺在一个单独的平皿上(或软琼脂中),可以先在微量离心机上室温离心 20 s以收集转化菌,在轻拍管壁的同时加入 100 μl SOC 重悬沉淀。
重要:玻璃铺菌器先需在乙醇中浸泡,然后在酒精灯上灼烧,待它凉至室温后,才可将转化菌轻轻地铺在琼脂板表面。
如检査氨芐青霉素的抗性,用转化菌铺平板时密度应较低(每个 90 mm 平板不超过 104 菌落 ),于 37℃ 培养的时间不超过 20 h。氰苄青霉素抗性的转化体可将β-内酰胺酶分泌到培养基中,迅速灭活菌落周围区域的青霉素。这样,铺平板时密度过高或培养时间过长都会导致出现对氰苄青霉索敏感的卫星菌落。在选择培养基中不用氨苄青霉素而用羧苄青霉素,以及将抗生素浓度从60 μg/ml 提高到 100 μg/ml,可使情况有所改善,但不能彻底根除之。抗氨芐青霉素菌落的增加与平皿上所加的细菌数的增加并无线性比例关系,这可能是因为被抗生素杀死的细胞释放生长抑制物质的缘故。
(18) 将平板置于室温直至液体被吸收。
(19) 倒置平皿,于 37℃ 培养,12~16 h 后可出现菌落。