RAP-PCR 方法
简介
RAP-PCR 方法,英文名是 RNA arbitrarily primed PCR fingerprinting,是 AP-PCR 不限于基因组指纹分析,用于 RNA 指纹分析的方法。
原理
RAP-PCR 方法的基本原理:
用适当选择的一系列人工随机合成的寡聚核昔酸单链为引物,以所研究的基因组 DNA 或 RNA 反转录产生的 cDNA 为模板进行 PCR 扩增。若引物在模板 DNA 的两条链上有互补位点,且方向正确,距离在一定长度范围内,就可以扩增出 DNA 片段,多个随机引物可以使检测区域扩大至整个基因组。扩增产物经琼脂糖或聚丙烯酰胺凝胶电泳分离,EB 染色或放射性自显影得到 DNA 指纹图谱,进而分析比较其多态性。这些扩增 DNA 片段的多态性反映了基因组 DNA 相应区域的多态性。
用途
RAP-PCR 方法可用于病原菌基因分型与检测研究、物种亲缘关系鉴定与研究、昆虫学研究构建遗传连锁图谱研究、克隆特异基因探针方面、动物品系鉴定及遗传监测方面、核心种子资源保存和鉴定方面、鉴定差异表达基因方面等领域的研究。
材料与仪器
器材:PCR 仪
试剂:
① 1 mol/L Tris-HCl (pH 8.0)
② 1 mol/L Tris-HCl (pH 8.3)
③ 1 mol/L KCL
④ 1 mol/L MgCl2
⑤ 0.1 g/L 明胶
⑥ 5 mmol/L 各种 dNTP
⑦ 1 mmol/L DTT
⑧ 10 μmol/L 引物
⑨ [α-32P]dCTP
⑩ 无 RNase 的 DNase I
⑪ MuLVRT
⑫ Tag DNA 聚合酶
步骤
RAP-PCR 方法的基本过程可分为如下几步:
(一)流程一
引物:用任意引物 PCR 法进行 RNA 的指纹分析通常需要两种引物,即反转录引物和 PCR 引物。
前者一般采用 oligo (dT) 来起始 cDNA 合成,也有人直接采用任意引物起始第一链 cDNA 的合成。
后者的设计与使用原则与 AP-PCR 法相同。
(二)流程二
模板:
A. 用异硫氰酸胍-氯化铯离心法或异硫氰酸胍-酸酚-氯仿抽提法制备总 RNA 最终的沉淀溶于 100 μl 水中。
B. 加入 100 μl 2× DNase I 处理混合物:20 mmol/L Tris-HCl (pH 8.0),20 mmol/L MgCl2,200 U/ml 无 RNase 的 DNase I,37 °C 温育 30 min。酚-氯仿抽提,乙醇沉淀。
C. 用紫外分光光度计测定 RNA 的浓度。将 RNA 用水稀释为两个浓度,分别大约 20 ng/μl 和 4 ng/μl。
(三)流程三
反转录:
A. 在冰浴中配制反转录反应液,于 10 μl 每种浓度的 RNA 中加入 10 μl 2×第一链反应混合物:100 mmol/L Tris-HCl (pH 8.3),100 mmol/L KCl,8 mmol/L MgCl2,20 mmol/L DTT,0.4 mmol/L 每种 dNTP,4 μmoI/L 反转录引物,2 U/μl MuLVRT。
B. 在热循环仪中 37 ℃ 温育 10 min,然后 94 °C 2 min 灭活反转录酶,最后冷却至 4 °C。
(四)流程四
任意引物 PCR:
A. 在每个 20 μl 的第一链合成反应液中再加入 20 μl 2×第二链反应混合物:20 mmol/L Tris-HCl (pH 8.3),20 mmol/L KCl,8 mmol/L MgCL2,0.4 mmol/L 每种 dNTP,0.1 μCi/μl [α-32P]dCTP,0.4 U/μl Taq DNA 聚合酶,8 μmol/L 任意引物。
B. 先做一个低严紧性的循环,如 94 °C 1 min、40 °C 5 min、72 °C 5 min,然后再做 35 个高严紧性的循环,如 94 °C 1 min、60 °C 1 min、72 °C 1 min。
(五)流程五
检测:
每个反应液 4 μl 用 18 μl 95% 甲酰胺稀释,94 °C 加热 2 min,然后取 1.5 μl 加样到 5% 聚丙烯酰胺-50% 尿素的测序胶上,用 1×TBE 缓冲液,50 V 电泳 3 h, 干燥凝胶,X 射线胶片放射自显影 12 h。
注意事项:
通常可看到约 50~1000 个碱基的片段。
注意事项
(1) 模板 DNA 的质量问题
任意引物 PCR 获得的实验结果的可重复性是大家普遍关心的问题,这类问题的大部分原因是由于制备的模板 DNA 质量不合格造成的,检查 DNA 质量是否合格的最简单的方法是在 200ng?200ng 这一范围内对 DNA 作一系列二倍稀释,如果一定浓度的 DNA 稀释物用不同的引物均不能产生可靠的指纹,那么模板的质量便值得怀疑了。
解决这一问题的方法是:①制备较高质量的 DNA 模板,避免污染非靶 DNA 序列;②选择合适的模板 DNA 浓度,每种样品实验开始时至少要用两种浓度的 DNA 模板进行分析。
(2) 引物的选择
不是所有的引物均能使特异产物扩增而得到有意义的结果,所以应进行多个引物尝试,从中选择出较为理想的分析引物,一般情况下应该选择能产生中等复杂度的图谱的引物。
(3)PCR 反应条件
缓冲液成分 (特别是镁离子浓度) 和反应条件都可以对任意引物 PCR 的结果产生影响,每次实验前都应该进行反应成分和条件的优化,并同时设立阴、阳性对照。
(4) 扩增结果中出现的弱带的分析
弱带形成的原因有多种,那些重复性好的弱带可能是因为引物与模板不能完全匹配造成的,这类弱带可以记录,但退火温度提高就会影响这些实验结果的稳定性。那些重复性不好的无规律出现的弱带可能是由非专一扩增、产物间退火或者其它人为因素造成的,不能记录。
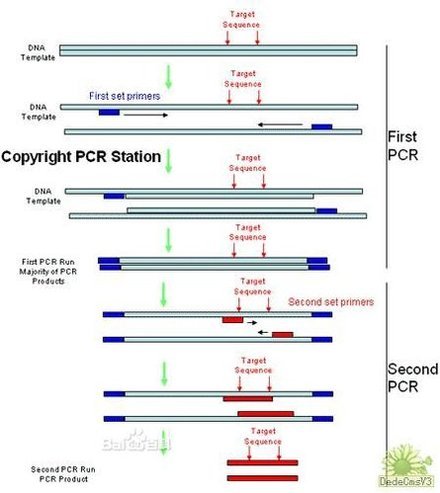
(5)RNA 丰度是影响 RAP-PCR 扩增结果的最常见因素解决这个问题,一是提高起始步骤的严紧性,二是采用嵌套式 RAP-PCR,即取第一次 RAP-PCR 的少量样品,在高严紧性条件下,用那些在第一引物序列的 3』端加上一个、两个或三个任意选择核昔酸的第二嵌套式引物做进一步的扩增。