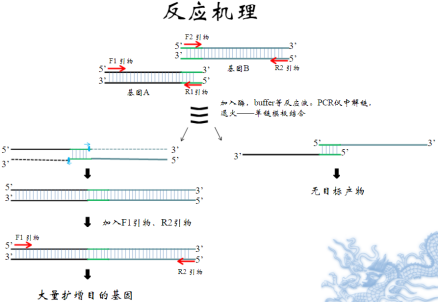
免疫PCR
原理主要由两个部分组成,第一部分的免疫反应类似于普通的酶联免疫吸附试验(ELISA)的测定过程;第二部分即通常的PCR检测,抗原分子的量最终由PCR产物的多少来
原理
主要由两个部分组成,第一部分的免疫反应类似于普通的酶联免疫吸附试验(ELISA)的测定过程;第二部分即通常的PCR检测,抗原分子的量最终由PCR产物的多少来反映。第一步中,首先用待测抗原(如牛血清白蛋白(ESA))包被微滴板孔,再加入相应的特异抗体,于是抗体就与固相上的抗原结合形成抗原抗体复合物,蛋白A-链亲合素(Protein A-Streptavidin)嵌合体(重组融合蛋白)中的蛋白A部分可与固相上抗原抗体复合物中的抗体IgG结合,而链亲合素部分可与生物素化的pUC19(质粒DNA) (Biotin-pUC19)中的生物素反应,从而将特定的DNA间接吸附于固相。接下来,就是第二步中的PCR过程,第一步中吸附于固相的pUC19质粒DNA在相应的引物存在下,可经PCR在几小时内而放大数百万倍,PCR产物的多少与固相上抗原的量成正比。
PCR由以下五部分构成:
(1)待测抗原;
(2)生物素化抗体;
(3)亲和素(连接分子);
(4)生物素化DNA;
(5)PCR扩增。
(1)待测抗原;
(2)生物素化抗体;
(3)亲和素(连接分子);
(4)生物素化DNA;
(5)PCR扩增。
主要程序:
(1) 抗原+生物素化抗体→抗原-生物素化抗体复合物;
(2) 加亲合素→抗原-生物素化抗体-亲合素复合物;
(3) 加生物素化DNA→抗原-生物素化抗体-亲合素-生物素化DNA;
(4) PCR扩增生物素化DNA部分。
材料与仪器
抗原样品
包被缓冲液 洗涤液 稀释液 琼脂糖凝胶
微滴板 电泳仪 电泳槽
包被缓冲液 洗涤液 稀释液 琼脂糖凝胶
微滴板 电泳仪 电泳槽
步骤
一、制备生物素化DNA
将噬粒 BLuescript skt,用生物素标记的M13引物进行PCR扩增制备出含T3和T7引物序列的280 bp DNa段,即为生物素化DNA。
二、免疫PCR模式
1. 试剂
包被缓冲液:20 mmol/L Tris-HCI(pH9.5),含150 mmol/L NaCl和0.02%NaN3;
洗涤液:20 mmol/L Tris-HCI(pH7.5),含150 mmol/LNaCl 0.1 mmol/L EDTA和0.1%Tween20;
稀释液:20 mmol/L Tris-HCI(pH7.5),含150 mmol/L NaCl 0.45%脱脂奶及变性鲑鱼精DNA (0.1 mg/ml)。
2. 操作
(1) 包被
用包被缓冲液稀释抗原(BSA),加入微滴板中(45 μl孔),4℃过夜(约15 h),用洗涤液洗板3次×5 min。
(2) 封闭
每孔加200 μl含4.5%脱脂奶及变性鲑鱼精子DNA(1 mg/ml)、0.1 mmol/L EDTA的20 mmol/L Tris-Hcl(pH7.5)(含150 mmol/L NaCl缓冲液,37℃温育80 min,洗板数次。
(3) 抗原抗体反应
用释释液1:8 000稀释单克隆抗BSA抗体,每孔加50 μl,室温(22℃)下45 min,洗板孔15次×10 min,去除未结合的抗体分子。
(4) 链亲合一蛋白A结合反应
每孔加入50 μl用稀释液稀释的已与生物素-pUC19结合的链亲合素-蛋白A嵌合体,室温(22℃)50 min,使得嵌合体-pUC19结合于固相的抗原抗体复合物上,然后洗板15次×10 min,再用无NaN3的TBS洗3次,然后即可将微滴板用于后面的PCR反应。
(5) PCR
实验条件 50 mmol/L KCI、10 mmol/L Tris-HCI(20℃pH8.3)、1.5 mmol/LMgCl2、明胶(10 μg/ml)、0.8 mmol/LdNTPs(每种0.2 mM)、2 μM引物(每一引物1 μM)和TaqDNA多聚酶(50 U/ml)。
三、PCR周期
PCR前,用紫外线(UV)(254 nm)照射上述反应混合物,然后将之加入到微滴板孔中,每孔40 μl,再加20 μl UV照射的石蜡覆盖,按下述温度在PCR仪上进行PCR周期:起始变性94℃5 min;30个周期:变性94℃5 min,退火58℃1 min,延伸72℃1 min,最后延伸72℃ 5 min,得到的PCR产物为特定的261 bp的片段。
1. 用0.85% NaCl将细菌溶液稀释至一定浓度;
2. 加50 μl于微孔板内,4℃过夜。同时设阴性对照(加50 μl 0.85% NaCl于另一孔内);
3. 用400 μl的0.05% 温20pBS(以下简称TPBS),洗涤五次;
4. 加入2.25%的100 μl正常山羊血清(NGS) PBS封闭2小时;
⒌ 用含0.15% NGS的TPBS洗3次;
⒌ 用含0.15% NGS的TPBS洗3次;
6. 加入100 μl用0.75% NGS适当稀释的单克隆抗体(内含100 μg的鲜鱼精DNA),室温孵育30 min;
7. 用TPBS洗涤五次;
8. 加入50 μl适量稀释的生物素化抗鼠IgG抗体,室温孵育30 min;
9. 用TPBS洗涤五次;
10. 加入60 μl适量稀释的生物素化DNA和亲和素,室温孵育30 min;
11. 用TPBS洗涤五次,再用HPLC级水洗三次;
12. PCR扩增:加入50μl PCR反应液(内含T3和T7引物),95℃ 60 s,50℃ 110 s,72℃ 110 s,循环30次。取PCR产物10 μl于1.7%琼脂糖凝胶上电泳,和核酸分子量标准相比较,在相应的位置邮现电泳带为阳性。必需时将电泳结果照像,进行定量分析。
常见问题
一、发展
免疫PCR技术目前尚处于研究阶段,还没有一个十分成熟和满意的方法,配套试剂尚缺乏,所以应用的还不多,在报道的几种方法中均是用一些已知的标准品进行试验。Sano,Ruzicka和Hong zhou分别用牛血清白蛋白、小鼠IgG和重组人原癌基因产物ETS;蛋白作为待检抗原进行免疫PCR,他们的结果均表明免疫PCR的敏感性比ELISA高105倍,且PCR产生的背景信号很弱,可以检测到几百个分子的抗原,在理论上免疫PCR可以检测到一个分子抗原,因此,免疫PCR特别适用于检测一些含量特别少的抗原分子。目前介绍的免疫PCR还存在一些缺点,在报道的文献中均采用待检抗原直接吸附固相,这样固相的均质性必然对结果有很大的影响;同时检测的样品液中其它成分也可以吸咐固相,极易产生背景过高或精确度下降。另外,有些难于吸咐固相的抗原也就不能用免疫PCR检测,连接分子的特异性和均质性对PCR影响很大,从理论上看Hong zhou的生物素标记抗体和DNA以及用游离的链亲和素连接抗体和DNA是一比较理想的方法,但是如能做到生物素化抗体、亲和素和生物素化DNA3个分子预先连接一个复合物,那么将简化实验过程。PCR扩增过程相对简单,如用微量板作为固相需选用配套的PCR仪,否则需将其移入反应管内,这必然导致很大的误差,经放大可产生显著差异。固相也可以直接采用某些PCR反应管,并且可以直接用一般的PCR仪进行扩增,但冲洗过程相对复杂一些。免疫PCR具有非广泛的应用前景,十分有必要进一步完善免疫PCR的实验过程和配套试剂的研制。
二、应用
荧光PCR是分子诊断的热点技术,它将先进的定量PCR与实时PCR技术相结合,西安天隆生产的国产实时荧光定量PCR仪为肝炎艾滋病等重大疾病的定量核酸检测及分子诊断、同时也为沙门氏菌阪崎氏肠杆菌等食品安全检测提供了先进手段。即使在发达国家,荧光定量PCR仪和基因扩增仪都被广泛用于临床及生物学、医学研究。由于其极高的灵敏度、极宽的检测范围,以及精确定量、方便快速、无窗口期等优点,美国FDA及中国国家标准已将定量PCR仪规定为确诊禽流感等传染病以及奶粉等食品安全检测的必备仪器。