慢病毒转导和筛选
简介
根据所需的用途,sgRNA 库可以由慢病毒、逆转录病毒或腺相关病毒(AAV)提供。慢病毒和逆转录病毒整合到基因组中,而腺相关病毒不整合, 因此对于筛选,腺相关病毒的递送仅限于非分裂细胞。相反,逆转录病毒只转导分裂细胞。此外,与慢病毒和逆转录病毒相比,腺相关病毒的插入容量更小。因此,到目前为止,大多数的筛选依赖慢病毒递送。
材料与仪器
器材:离心管、Stericp 过滤器、12 孔板等
试剂:
① Opti-MEM I 还原血清培养基(Thermo Fisher, cat. no. 31985062)
② pMD2.G(Addgene, cat. no. 12259)
③ psPAX2(Addgene, cat. no. 12260)
④ pcDNA3-EGFP 转染控制质粒(Addgene, cat. no. 13031)
⑤ Lipofectamine 2000 转染试剂(Thermo Fisher, cat. no. 11668019)
⑥ PLUS 试齐 U(Thermo Fisher, cat. no. 11514015)
⑦ Polyethylenimine HC1 MAX, 线性,分子量 40000(PEI Max; Polysciences, cat. no. 24765-1)
⑧ 聚凝胺(Hexadimethrine bromide; Sigma-Aldrich, cat. no. 107689-10 G)
⑨ Blasticidin S HC1(Thermo Fisher, cat. no. Al 113903)
⑩ 二盐酸瞟吟霉素(Thermo Fisher, cat. no. Al 113803)
⑪ 潮霉素 B(Thermo Fisher, cat. no. 10687010)
⑫ 博来霉素(Thermo Fisher, cat. no. R25001)
⑬ CellTiter-Glo 发光细胞活力测定(Promega, cat. no. G7571)
步骤
慢病毒转导和筛选的基本过程可分为如下几步:
A. 具有稳定表达的 Cas9 组分的细胞系的产生。在转导 sgRNA 文库之前, 以 MOK0.7 的比率转导 sgRNA 文库骨架中不存在的附加 Cas9 组分至相关细 胞系。如果需要另外两个 Cas9 组分,例如 dCas9-VP64 和 MS2.p65-HSFl, 则 可以同时转导两个组分。在 sgRNA 文应转导和选择后,根据需要扩大规模,生成足够的细胞来维持 sgRNA 的表达。克隆产生的 Cas9 或 SAM 组分对筛选 成功不是必要的。因此,这些细胞可以在所需的规模上作为一个群体被转导 和选择。下面介绍 HEK 293FT 细胞(A)和 hESC HUES66 细胞(B)的慢病 毒转导和细胞系生成方法。
1)HEK 293FT 细胞系的生成。
1. 在 12 孔板中每孔加入 2 mL D10 培养基及 8 gg/mL 的聚凝胺,接种细胞 且细胞密度为 3X106 将来自步骤您)的适量的慢病毒上清液添加到每个孔中, 包含无病毒的对照。通过上下吹打将各孔充分混合。
2. 将 12 孔板在 33℃ 下 l000Xg 旋转 2 小时,对细胞进行感染。之后将 12 孔板放回培养箱。
3. 离心转染结束后 24 小时,除去培养基,每孔用 400 μL TrypLE 轻轻洗涤, 添加 100 μL TrypLE, 并在 37 °C 孵育 5 min 以解离细胞。向每个孔中加入 2 mL D10 培养基以及用于慢病毒的选择抗生素,然后通过上下吹打混合均匀。
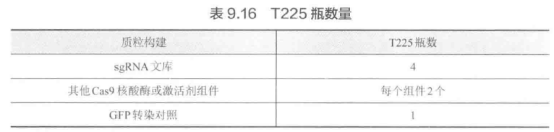
4. 将重悬的细胞从慢病毒处理的孔中取出,接种到 T225 瓶中,细胞密項 为 9X 1 个/瓶,加入 45 mL 含选择抗生素的 D10 培养基。
5. 将无病毒对照组的重悬细胞转移到 T75 中,加入 13 mL D10 培养基和 选择性抗生素。
6. 每 3 天更换一次选择抗生素,并根据需要在 4~7 天内传代,直到无 病毒对照中没有活细胞为止。
2)HUES66 细胞系的生成。
1. 在 Geltrex 包被的 6 孔板中,每孔加入 2 mL mTeSRl 培养基,接种细胞 且细胞密度为 5X105。将来自慢病毒产生和滴度的适量慢病毒上清液添加到每个孔中,包含无病毒的对照。用 DPBS 补充每孔总体积至 3 mL。通过上下吹打将各孔充分混合。
2. 慢病毒转导 24 小时后,用會仃相应选择抗生素的 mTeSRl 更换培养辰 每天都要用含有相应选择抗生素的 mTeSRl 更换培养基,根据需要在 4~7 天内传代,直到无病毒的对照组中没有活细胞为止。关键步骤:生成用于筛 选的细胞系的慢病毒转导方法应与病毒滴度测定的方法一致,以确保细胞在 适当的 MOI 转导。
B. 在选择了成功转导的细胞后,在 sgRNA 文库转导之前通过将细胞在正常培养基中培养 2~7 天,使细胞恢复活力。如果在选择后或细胞冷冻后 培养细胞超过 7 天,请使用适当的选择性抗生素重新选择 Cas9 组分细胞系, 以确保 Cas9 组分的表达并且保证细胞在 sgRNA 文库转导前恢复。细胞可以冻存。
C. sgRNA 文库转导细胞。重复步骤 A~B,以在适当的 MOI T 进行 慢病毒 sgRNA 库转导并选择转导的细胞系。为了确保大多数细胞仅接受一 种基因干扰,以 MOI < 0.3 转导 sgRNA 文库。扩大转导规模,使 sgRNA 文 库在 >500 个细胞中表达每个 sgRNAo 例如,对于包含 100000 个独特 sgRNA 的文库,以 0.3 的 MOI 转导 1.67X108 个细胞。经过 4~7 天的适当选择后, 即可进行细胞筛选。对于敲除筛选,在 sgRNA 转导后 7 天达到最大的敲除效 率,因此建议在七天后开始筛选。相反,最大的 SAM 激活最早在 sgRNA 转 导后 4 天就出现。如果在无病毒控制的基础上完成选择,则可以在转导后 5 天开始功能增益筛选。通常建议进行 4 次独立的筛选生物学重复(biorep)(即 4 次单独的 sgRNA 文库感染,然后进行单独的筛选选择)。多重筛选 biorep 是 以高验证率确定筛选结果的关键。关键步骤:每个 sgRNA 的覆盖范围应大于 500 个细胞,以确保在最终的筛选读长中可以充分体现每种干扰。如果筛选选 择压力不太强或执行否定选择筛选,则根据需要增加覆盖范围。在 MOI < 0.3 的情况下转导 sgRNA 文库可确保大多数细胞最多接受一种基因干扰。以更高的 MOI 进行转导可能会混淆筛选结果。