CHO细胞表达四大常见问题解析
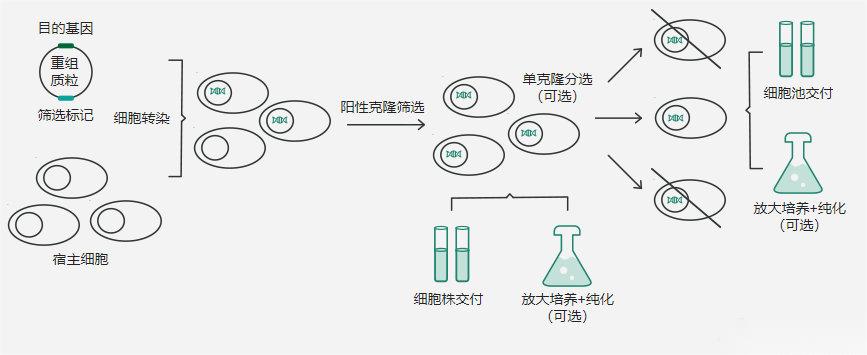
稳定细胞系构建服务包含:过表达细胞系构建服务和CHO稳定细胞株开发服务。
过表达细胞系的开发首先是将外源基因导入宿主细胞,随后通过抗性基因进行筛选,并最终经鉴定得到目的基因持续过表达的细胞株。义翘神州在慢病毒载体系统和慢病毒介导稳定株构建方面具有丰富的经验,特别是针对RNAi研究和体内实验中难以转染的细胞(比如神经元细胞、干细胞或其它原代细胞),高效为客户提供稳定表达特定基因的多种细胞株服务,同时也满足您制备多种标记个性化定制服务。适用场景包括基础研究(基因功能研究)、药物筛选(CAR开发前期scFV筛选)等,满足多样化实验需求。
下面是利用稳定细胞系CHO细胞表达常见问题见解:
问:请问有人养过CHO细胞吗?文献报道说用DMEM培养基来养,但我不太清楚具体是高糖还是低糖?
答:CHO细胞用高糖DMEM养就可以了,比较好养,10%血清,小牛和胎牛都可以,长得比较慢,跟你所用的血清有一定的关系,大概需要两天传一次代。在塑料板上比玻璃板上好养,感觉如果在玻璃板上养而且不包被的话,好像细胞不易伸展开来。
问:要转染钾通道pcDNA3.1入细胞,是选cho细胞呢还是hek293细胞?cho细胞转染效率高吗?
答:表达一个蛋白的时候,首先要确认你的蛋白确实表达了,因为有很多原因可以导致蛋白表达出问题(质粒序列有错误,质粒纯度低,表达的蛋白不稳定,转染效率太低等)。所以在做任何功能性实验之前,必须要先确认蛋白的表达,通常的实验有:
(1)采用免疫荧光法。由于需要荧光二抗,比较贵。但直观,可以确定转染效率,采用好的显微镜时,可以大致知道表达蛋白在细胞中的位置。
(2)WESTERN-BLOT。可以确认表达的蛋白分子量,以及表达的量。但不直观。
(3)构建一个N或C端带荧光蛋白的质粒。这样比较费时间,同时携带的荧光蛋(通常使用GFP)有可能干扰蛋白的正常功能。但好处是转染后可以很方便的观察转染效率,蛋白在细胞中的位置等。
当然以上方法都无法知道质粒有无发生突变,所以如果你的蛋白有表达但没有功能,首先要做一个DNA测序确认你的序列没有问题。事实上质粒发生突变的机会比大多数人想象的要多得多!
问:由于我要用CHO细胞生产基因工程抗体,用什么培养基能够很好的使之良好的生长
答:培养CHO细胞最好用F12,并且由于F12中加入了一些微量元素与无机离子,因此可以在血清很少的情况下应用,是无血清培养中常用的基础培养基,特别适合进行单细胞培养和克隆化培养。我们的前辈曾用F12在无血清的条件下成功的克隆出CHO细胞。
无血清培养CHO细胞有两种方法:一种是直接向试剂公司购买只适用于培养CHO细胞的无血清培养基(好像HyClone就有);第二种方法实际上是有血清培养,只不过血清浓度很低罢了,可以近似的认为无血清。在第二种方法里,又可以分出两条途径:你可以分步进行,也可以一步到位。分步法是,CHO细胞先在含10%血清的常规培养基里培养,再到含5%血清的培养基里培养,再到含2.5%血清的培养基里培养,依此类推,培养基里的血清不断下降,直到一个能让CHO细胞良好生长的最低血清浓度。一步到位法就是省去中间的步骤,直接由起点的血清浓度到终点浓度。
问:我要做稳定转染,表达融合蛋白并将蛋白质纯化来检测其功能。仅仅把目的基因插入pcDNA3.1,没有插入其他的基因或者tag。现准备转染CHO细胞。就相关问题想问问:有的文献上没有署名K1或是DHFR,普通所写的CHO细胞是指那种?野生型CHO细胞又是指的哪种?这三种细胞是不是因为CHO-K1和CHO/DHFR-有扩增基因GS 和DHFR,可以更为有效的扩增进而表达,比野生型CHO在转染中更起作用?如果就我的实验要求,CHO-K1或者CHO/DHFR-更加适合,那么转染CHO-K1是不是可以直接转染?而转染CHO-DHFR-需要和携带DHFR-的标记质粒共转染?
答:做稳定表达是需要把目的基因克隆到一定的载体上的,这个载体同时可以过表达一个抗性基因,如果载体整和到基因组上,这个抗性已经能够克服筛选压力,而这个时候你的目的蛋白也得到了有效的表达。
(1)野生型CHO就是CHO-K1
(2)CHO-DHFR-是指DHFR缺陷型细胞,DHFR作为筛选标记.
(3)你用pcDNA3.1的话,可以直接转染CHO-K1,加G418筛选即可。