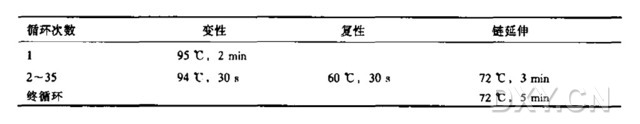
琼脂糖凝胶中DNA的检测
原理琼脂糖凝胶中的核酸通过染色,可以在波长为 300 nm 的紫外灯下检测。介绍琼脂糖凝胶中核酸染色的两种方法:溴化乙锭(ethidium bromide, E
原理
琼脂糖凝胶中的核酸通过染色,可以在波长为 300 nm 的紫外灯下检测。介绍琼脂糖凝胶中核酸染色的两种方法:溴化乙锭(ethidium bromide, EB ) 染色法和 SYBR Gold 染色法。
材料与仪器
溴化乙锭 SYBR Gold
步骤
1. 凝胶溴化乙锭染色法
观察琼脂糖凝胶中 DNA 的最简便、最常用的方法是利用荧光染料溴化乙锭进行染色(Sharp et al. 1973)。溴化乙锭含有一个可以嵌入 DNA 堆积碱基之间的一个三环平面基团。它与 DNA 的结合几乎没有碱基序列特异性。在高离子强度的饱和溶液中,大约每 2.5 个碱基插入一个溴化乙锭分子(Waring 1965)。当染料分子插入后,其平面基团与螺旋的轴线垂直并通过范德华力与上下碱基相互作用。这个基团的固定位置及其与碱基的密切接近,导致与 DNA 结合的染料呈现荧光,其荧光产率比游离溶液中染料的有所增加。DNA 吸收 254 nm 处的紫外辐射并传递给染料,而被结合的染料本身吸收 302 nm 和 366 nm 的光辐射。这两种情况下,被吸收的能量在可见光谱红橙区的 590 nm 处重新发射出来(LePecq and Faoletti 1967)。由于溴化乙锭-DNA 复合物的荧光产率比 没有结合 DNA 的染料高出 20~30 倍,所以当凝胶中含有游离的溴化乙锭(0.5 μg/ml) 时,可以检测到少至 10 ng 的 DNA 条带。

溴化乙锭可以用来检测单链或双链核酸(DNA 或 RNA〉。但是染料对单链核酸的亲和力相对较小,所以其荧光产率也相对较低。事实上,大多数对单链 DNA 或 RNA 染色的荧光是通过染料结合到分子内形成较短的链内双螺旋产生的。
通常用水将溴化乙锭配制成 10 mg/ml 的贮存液,于室温保存在棕色瓶中或用铝箔包裹的瓶中。这种染料通常掺入琼脂糖凝胶和缓冲液的浓度为 0.5 μg/ml。注意:聚丙烯酰胺凝胶灌制时不能掺入溴化乙锭,这是由于溴化乙锭能够抑制丙烯酰胺聚合。丙烯酰胺电泳通常在电泳结束后用溴化乙锭染色。
尽管在该染料存在的情况下,线状 DNA 的电泳迁移率约降低 15%, 但是最大的优点是在电泳过程中或在电泳结束后能直接在紫外灯下检测。当凝胶中没有 EB 时,凝胶中的 DNA 条带更为清晰。因此,当需要知道 DNA 片段的准确大小(如 DNA 限制酶酶切图谱的鉴定),凝胶应该在无 EB 情况下电泳,电泳结束后用 EB 染色。染色时,将凝胶浸入含有 EB(0.5 μg/ml ) 的电泳缓冲液中,室温下染色 30~45 min。染色完毕后,通常不需要脱色。但是在检测小量 DNA (<10 ng )片段时,通常要将染色后的凝胶浸入水中或 1 mmol/L MgSO4 中,室温脱色 20 min 更易观察到。
2. 凝胶 SYBR Gold 染色法
SYBR Gold 是一种新型的极敏感的染料的商品名称。其与 DNA 结合的亲和力高, 并且结合后,能够极大的增强荧光信号。SYBR Gold-DNA 复合物产生光子的量比 EB-DNA 复合物要大的多,同时其激发的荧光信号强度是 EB-DNA 复合物的 1000 多倍。因此用 SYBR Gold 染色可以检测出琼脂糖凝胶中小于 20 pg 的双链 DNA ( 是 EB 染色最低检测量的 1/25 ) 。此外,利用 SYBR Gold 染色可以检测出一个条带少至 100 pg 的单链 DNA 或 300 pg 的 RNA。SYBR Gold 染料的最大激发波长为 495 nm。同时在 300 nm 有第二个激发峰。其发射的荧光波长为 537 nm。下面是关于 SYBR Gold 详细的介绍。

DNA 片段经过凝胶电泳分离后,用 SYBR Gold 贮存液的稀释液(1:10000) 浸染凝胶。不能将 SYBR Gold 加入熔化的凝胶中或电泳前加入凝胶,这是由于在 SYBR Gold 存在的情况下,凝胶中核酸的电泳条带会产生严重变形。
当用 SYBR Gold 染色的凝胶在波长为 300 nm 的紫外照射下具有最高的灵敏度。可以像后面介绍的那样通过绿色或黄色的滤光片来照像。由于 SYBR Gold 对荧光敏感, 所以其工作液(1:10000 稀释的贮存液)应该当天用电泳缓冲液新鲜配制,室温存放。
3. 凝胶中 DNA 的成像
可以用透射或入射紫外光对 EB 染色的凝胶成像。大多数市售的紫外光源发射光的波长为 302 nm。在这一波长下,EB-DNA 复合物的荧光产率远远高于在波长 366 nm 处,而略小于在波长 254 nm 处。在波长 302 nm 处,DNA 产生缺口的程度比在 254 nm 处要低的多(Brunk and Simpson 1977)。
现在可以用完整的成像系统检测 EB 染色的凝胶。该系统主要包括光源、固定焦距的数码相机和热能打印机。在这些系统中的 CCD 相机,采用一种广角变焦镜头(焦距为 75 mm)。这种相机可以检测出痕量的 EB 染色 DNA ( 声称达 0.01~0.5 ng)。在更为 先进的成像系统中,凝胶图像可以直接输出到计箅机,直接观察。图像在打印之前,可以在计算机的显示器上进行各种处理,包括视野、焦距和累积曝光时间等方面。每一个图像都可以被打印和贮存成各种形式的文件,并且可以通过软件来进一步处理图像。一 张琼脂糖图片的文件大小约为 0.3 M 字节。因此,若要保存大量的图片,需要一个大贮存量的系统。尽管单个图片的打印仅需花费几美分,而通过宝丽来成像需花费约 1 美元,但是一个小的成像系统都需几千美元,加上其他一系列附件则需花费更多。VENDORS 公司出售的凝胶成像系统,主要包括: AlpHa Innotech ( San Leandro, California)、 Fotodyne (Hartland, Wisconsin) 和 Stratagene (La Jolla, California)。

尽管可以通过凝胶成像系统获得的图片及时进行结果分析,但是打印的图片在保存的过程中容易褪色,也缺少层次。所以要获得更为满意的、保持时间长久的图片,应采用高灵敏度的宝丽来胶片 57 型或 667 型( ASA 3000)。用高效的紫外光源(>2500 mW/cm2),一块 Wratten 22A ( 红或橘红)滤光片以及性能良好的镜头(f=135 mm),曝光数秒后就可以获得少至 10 ng DNA 的条带图片。若延长曝光时间并且采用强紫外光源,可以在胶片上记录到仅 1 ng DNA 所激发的荧光。用常规的湿法处理胶片(如 Kodak No.4155) 同时采用更小焦距(f=75 mm) 的镜头,可以检测出痕量 DNA 条带。此时,镜头距离凝胶更近,成像集中在胶片的更小的区域。同时,这也可以更为灵活显影和晒印图片。
通过采用 SYBR Gold ( Molecular Probe) 对 DNA 染色,可以使成像的灵敏度提高 10~20 倍。当然在通过这种方法提高灵敏度同时,其花费也陡增。10L SYBR Gold 工作液价值超过 100 美元,而同样量的 EB 的价格约 5 美分。同时检测 SYBR Gold 染色的 凝胶需要釆用带黄色或绿色明胶或塞路玢滤片(S-7569, Molecular 或 Kodak) 的相机在波长 300 nm 的紫外透射光下进行。
观察琼脂糖凝胶中 DNA 的最简便、最常用的方法是利用荧光染料溴化乙锭进行染色(Sharp et al. 1973)。溴化乙锭含有一个可以嵌入 DNA 堆积碱基之间的一个三环平面基团。它与 DNA 的结合几乎没有碱基序列特异性。在高离子强度的饱和溶液中,大约每 2.5 个碱基插入一个溴化乙锭分子(Waring 1965)。当染料分子插入后,其平面基团与螺旋的轴线垂直并通过范德华力与上下碱基相互作用。这个基团的固定位置及其与碱基的密切接近,导致与 DNA 结合的染料呈现荧光,其荧光产率比游离溶液中染料的有所增加。DNA 吸收 254 nm 处的紫外辐射并传递给染料,而被结合的染料本身吸收 302 nm 和 366 nm 的光辐射。这两种情况下,被吸收的能量在可见光谱红橙区的 590 nm 处重新发射出来(LePecq and Faoletti 1967)。由于溴化乙锭-DNA 复合物的荧光产率比 没有结合 DNA 的染料高出 20~30 倍,所以当凝胶中含有游离的溴化乙锭(0.5 μg/ml) 时,可以检测到少至 10 ng 的 DNA 条带。

溴化乙锭可以用来检测单链或双链核酸(DNA 或 RNA〉。但是染料对单链核酸的亲和力相对较小,所以其荧光产率也相对较低。事实上,大多数对单链 DNA 或 RNA 染色的荧光是通过染料结合到分子内形成较短的链内双螺旋产生的。
通常用水将溴化乙锭配制成 10 mg/ml 的贮存液,于室温保存在棕色瓶中或用铝箔包裹的瓶中。这种染料通常掺入琼脂糖凝胶和缓冲液的浓度为 0.5 μg/ml。注意:聚丙烯酰胺凝胶灌制时不能掺入溴化乙锭,这是由于溴化乙锭能够抑制丙烯酰胺聚合。丙烯酰胺电泳通常在电泳结束后用溴化乙锭染色。
尽管在该染料存在的情况下,线状 DNA 的电泳迁移率约降低 15%, 但是最大的优点是在电泳过程中或在电泳结束后能直接在紫外灯下检测。当凝胶中没有 EB 时,凝胶中的 DNA 条带更为清晰。因此,当需要知道 DNA 片段的准确大小(如 DNA 限制酶酶切图谱的鉴定),凝胶应该在无 EB 情况下电泳,电泳结束后用 EB 染色。染色时,将凝胶浸入含有 EB(0.5 μg/ml ) 的电泳缓冲液中,室温下染色 30~45 min。染色完毕后,通常不需要脱色。但是在检测小量 DNA (<10 ng )片段时,通常要将染色后的凝胶浸入水中或 1 mmol/L MgSO4 中,室温脱色 20 min 更易观察到。
2. 凝胶 SYBR Gold 染色法
SYBR Gold 是一种新型的极敏感的染料的商品名称。其与 DNA 结合的亲和力高, 并且结合后,能够极大的增强荧光信号。SYBR Gold-DNA 复合物产生光子的量比 EB-DNA 复合物要大的多,同时其激发的荧光信号强度是 EB-DNA 复合物的 1000 多倍。因此用 SYBR Gold 染色可以检测出琼脂糖凝胶中小于 20 pg 的双链 DNA ( 是 EB 染色最低检测量的 1/25 ) 。此外,利用 SYBR Gold 染色可以检测出一个条带少至 100 pg 的单链 DNA 或 300 pg 的 RNA。SYBR Gold 染料的最大激发波长为 495 nm。同时在 300 nm 有第二个激发峰。其发射的荧光波长为 537 nm。下面是关于 SYBR Gold 详细的介绍。

DNA 片段经过凝胶电泳分离后,用 SYBR Gold 贮存液的稀释液(1:10000) 浸染凝胶。不能将 SYBR Gold 加入熔化的凝胶中或电泳前加入凝胶,这是由于在 SYBR Gold 存在的情况下,凝胶中核酸的电泳条带会产生严重变形。
当用 SYBR Gold 染色的凝胶在波长为 300 nm 的紫外照射下具有最高的灵敏度。可以像后面介绍的那样通过绿色或黄色的滤光片来照像。由于 SYBR Gold 对荧光敏感, 所以其工作液(1:10000 稀释的贮存液)应该当天用电泳缓冲液新鲜配制,室温存放。
3. 凝胶中 DNA 的成像
可以用透射或入射紫外光对 EB 染色的凝胶成像。大多数市售的紫外光源发射光的波长为 302 nm。在这一波长下,EB-DNA 复合物的荧光产率远远高于在波长 366 nm 处,而略小于在波长 254 nm 处。在波长 302 nm 处,DNA 产生缺口的程度比在 254 nm 处要低的多(Brunk and Simpson 1977)。
现在可以用完整的成像系统检测 EB 染色的凝胶。该系统主要包括光源、固定焦距的数码相机和热能打印机。在这些系统中的 CCD 相机,采用一种广角变焦镜头(焦距为 75 mm)。这种相机可以检测出痕量的 EB 染色 DNA ( 声称达 0.01~0.5 ng)。在更为 先进的成像系统中,凝胶图像可以直接输出到计箅机,直接观察。图像在打印之前,可以在计算机的显示器上进行各种处理,包括视野、焦距和累积曝光时间等方面。每一个图像都可以被打印和贮存成各种形式的文件,并且可以通过软件来进一步处理图像。一 张琼脂糖图片的文件大小约为 0.3 M 字节。因此,若要保存大量的图片,需要一个大贮存量的系统。尽管单个图片的打印仅需花费几美分,而通过宝丽来成像需花费约 1 美元,但是一个小的成像系统都需几千美元,加上其他一系列附件则需花费更多。VENDORS 公司出售的凝胶成像系统,主要包括: AlpHa Innotech ( San Leandro, California)、 Fotodyne (Hartland, Wisconsin) 和 Stratagene (La Jolla, California)。

尽管可以通过凝胶成像系统获得的图片及时进行结果分析,但是打印的图片在保存的过程中容易褪色,也缺少层次。所以要获得更为满意的、保持时间长久的图片,应采用高灵敏度的宝丽来胶片 57 型或 667 型( ASA 3000)。用高效的紫外光源(>2500 mW/cm2),一块 Wratten 22A ( 红或橘红)滤光片以及性能良好的镜头(f=135 mm),曝光数秒后就可以获得少至 10 ng DNA 的条带图片。若延长曝光时间并且采用强紫外光源,可以在胶片上记录到仅 1 ng DNA 所激发的荧光。用常规的湿法处理胶片(如 Kodak No.4155) 同时采用更小焦距(f=75 mm) 的镜头,可以检测出痕量 DNA 条带。此时,镜头距离凝胶更近,成像集中在胶片的更小的区域。同时,这也可以更为灵活显影和晒印图片。
通过采用 SYBR Gold ( Molecular Probe) 对 DNA 染色,可以使成像的灵敏度提高 10~20 倍。当然在通过这种方法提高灵敏度同时,其花费也陡增。10L SYBR Gold 工作液价值超过 100 美元,而同样量的 EB 的价格约 5 美分。同时检测 SYBR Gold 染色的 凝胶需要釆用带黄色或绿色明胶或塞路玢滤片(S-7569, Molecular 或 Kodak) 的相机在波长 300 nm 的紫外透射光下进行。