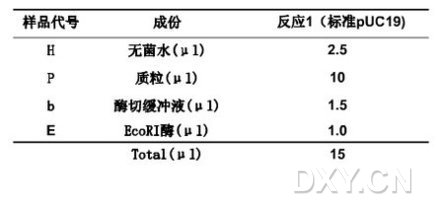
牙签法小量制备质粒DNA实验
原理用牙签从琼脂培养基上挑取的菌落可直接用于制备质粒 DNA。所得的闭合环状 DNA 往往杂质太多,不能作为大多数限制酶的底物。材料与仪器抗生素 溴酚蓝溶液 E
原理
用牙签从琼脂培养基上挑取的菌落可直接用于制备质粒 DNA。所得的闭合环状 DNA 往往杂质太多,不能作为大多数限制酶的底物。
材料与仪器
抗生素 溴酚蓝溶液 EDTA 溴化乙锭 NSS 溶液 KCl 琼脂糖凝胶
LB、YT 或 SOB 热循环仪 木质牙签
LB、YT 或 SOB 热循环仪 木质牙签
步骤
一、材料
1. 缓冲液和溶液
(1) 用于筛选质粒的抗生素
(2) 溴酚蓝溶液(0.4%,m/V)或甲酚红溶液(10 mmol/L)
(3) EDTA ( 0.5 mol/L,pH 8.0 )
(4) 溴化乙锭(10 mg/ml ) 或 SYBR Gold
(5) KCl ( 4 mol/L)
(6) NSS 溶液:0.2 mol/L NaOH,0.5% SDS,20% 蔗糖。
2. 凝胶
(1) 琼脂糖凝胶(0.7%,5 mm 厚),用不含溴化乙锭的 Tris-乙酸盐或 Tris-乙酸盐缓冲液配制及电泳。
当质粒大小只有很小的差别时,琼脂糖凝胶电泳应使用 Tris-硼酸盐电泳缓冲液(TAE),因为它溶解不同大小超螺旋 DNA 的能力更强。否则应使用 Tris-硼酸盐-EDTA ( TBE)缓冲液,因为它有更强的缓冲能力。
(2) 琼脂糖凝胶
3. 培养基
(1) LB、YT 或 SOB ( 用于培养 E.coli 的高营养肉汤培养基)
(2) LB、YT 或含适当抗生素的 SOB 琼脂平板
4. 专用设备
(1) 热循环仪
(2) 调至 70℃ 的水浴
(3) 木质牙签
二、方法
1. 细胞的制备
(1) 在含适当抗生素的富养琼脂培养基 ( LB、YT 或 SOB ) 上培养转化了适当质粒的菌落, 直到它们的直径长至 2~3 mm ( 对于大多数菌株,需在 37℃ 下培养约 18 ~24 h )。
(2) 用无菌牙签或一次性小环将细菌菌落的一小块转移到含适当抗生素的一条或一小块琼脂母板上,将该菌落的剩余部分转移到已编号的微量离心管中,管内含有 50 μl 无菌的 10 mmol/L EDTA ( pH 8.0 )。
除待实菌落外,还应转移几个“空” 菌落(不含外源基因的质粒载体)。这几个样品可在凝胶电泳中用做分子质量标准参照物。
(3) 重复步骤 2,直到收获预期数目的菌落。
(4) 当所有菌落都被复制和转移之后,将母板在 37℃ 培养几个小时后于 4℃ 保存,直到得到凝胶电泳结果。然后从母板上收获其质粒为预期大小的菌落。
(5) 在培养母板的时候,对细菌悬液进行以下的处理;在每一微量离心管中顺序加入 20 μl 新配置的 NSS 溶液。盖上管盖,振荡混匀 30 s。
(6) 将所有离心管转移到 70℃ 热水浴中放置 5 min,然后于室温冷却。
(7) 在各管中加入 1.5 μl 的 4 mol/L KCl 溶液,振荡混匀 30 s。
(8) 将离心管在冰上放置 5 min。
(9) 在 4℃ 下以最大速度离心 3 min 以除去细菌碎片。
2. 质粒的凝胶电泳分析
(1) 将上清依次转移到洁净离心管中。如果只用琼脂糖凝胶电泳分析样品,在每管中加入 0.4% 的溴酚蓝溶液;如果既要用琼脂糖电泳又要用 PCR 分析,则在样品中加入 2 μl 10 mmol/L 甲粉红。在 0.7% 的琼脂糖凝胶(5 mm 厚)的加样孔(5 mm 长,2.5 mm 宽)中加 50 μl 上清。
琼脂糖凝胶不含溴化乙锭,且所用的缓冲液也不含溴化乙锭,因为这样超螺旋 DNA 的迁移率比插入染料后更准确地反映其分子质量。这就能更容易地区分不同大小的质粒。
(2) 当溴酚蓝迁移到胶的 2/3 或 3/4 处,或甲酚红迁移到胶的一半时,室温下将胶浸在溴化乙锭溶液(0.5 μg/ml 的水溶液)中染色 30~45 min。在紫外灯下观察凝胶并拍照。
(3) 如果在 (1) 中使用甲酚红,则宜用 PCR 方法分析上清 ( 用各样品的剩余液作为模板 )。
甲酚红(Merk Index 公司)在酸性溶液中是橙色到琥珀色的,pH 为 7.2 时是黄色的,在碱性溶液中是红色的。与溴酚蓝和二甲苯蓝不同,甲酚红不抑制 DNA 聚合酶(Taq 聚合酶,从嗜热古细菌中提取)的热稳定性(Hoppe et al. 1992 )。因而,含甲酚红的 DNA 溶液在大多数扩增反应中可用。此染料在 2% 的琼脂糖凝胶中的迁移位于在二甲苯蓝和溴酚蓝之间,大小大约相当于 300 bp ( Hoppe et al. 1992 )。在琼脂糖凝胶电泳照片上,甲酚红不会产生像溴化乙锭染色一样的阴影。
(4) 将母板上可能含有重组子的菌落接种到含适当抗生素的 2 ml 液体培养基(LB、YT 或 SOB ) 中,进行小规模培养。
不需要等到母板上的菌落长到很大。细菌即使只是薄薄的一层,也足够接种用。
(5) 用此小规模培养物小量制备待测的重组子质粒。用酶切及琼脂糖电泳分析质粒 DNA,以确证其大小和结构与预期一致。
1. 缓冲液和溶液
(1) 用于筛选质粒的抗生素
(2) 溴酚蓝溶液(0.4%,m/V)或甲酚红溶液(10 mmol/L)
(3) EDTA ( 0.5 mol/L,pH 8.0 )
(4) 溴化乙锭(10 mg/ml ) 或 SYBR Gold
(5) KCl ( 4 mol/L)
(6) NSS 溶液:0.2 mol/L NaOH,0.5% SDS,20% 蔗糖。
2. 凝胶
(1) 琼脂糖凝胶(0.7%,5 mm 厚),用不含溴化乙锭的 Tris-乙酸盐或 Tris-乙酸盐缓冲液配制及电泳。
当质粒大小只有很小的差别时,琼脂糖凝胶电泳应使用 Tris-硼酸盐电泳缓冲液(TAE),因为它溶解不同大小超螺旋 DNA 的能力更强。否则应使用 Tris-硼酸盐-EDTA ( TBE)缓冲液,因为它有更强的缓冲能力。
(2) 琼脂糖凝胶
3. 培养基
(1) LB、YT 或 SOB ( 用于培养 E.coli 的高营养肉汤培养基)
(2) LB、YT 或含适当抗生素的 SOB 琼脂平板
4. 专用设备
(1) 热循环仪
(2) 调至 70℃ 的水浴
(3) 木质牙签
二、方法
1. 细胞的制备
(1) 在含适当抗生素的富养琼脂培养基 ( LB、YT 或 SOB ) 上培养转化了适当质粒的菌落, 直到它们的直径长至 2~3 mm ( 对于大多数菌株,需在 37℃ 下培养约 18 ~24 h )。
(2) 用无菌牙签或一次性小环将细菌菌落的一小块转移到含适当抗生素的一条或一小块琼脂母板上,将该菌落的剩余部分转移到已编号的微量离心管中,管内含有 50 μl 无菌的 10 mmol/L EDTA ( pH 8.0 )。
除待实菌落外,还应转移几个“空” 菌落(不含外源基因的质粒载体)。这几个样品可在凝胶电泳中用做分子质量标准参照物。
(3) 重复步骤 2,直到收获预期数目的菌落。
(4) 当所有菌落都被复制和转移之后,将母板在 37℃ 培养几个小时后于 4℃ 保存,直到得到凝胶电泳结果。然后从母板上收获其质粒为预期大小的菌落。
(5) 在培养母板的时候,对细菌悬液进行以下的处理;在每一微量离心管中顺序加入 20 μl 新配置的 NSS 溶液。盖上管盖,振荡混匀 30 s。
(6) 将所有离心管转移到 70℃ 热水浴中放置 5 min,然后于室温冷却。
(7) 在各管中加入 1.5 μl 的 4 mol/L KCl 溶液,振荡混匀 30 s。
(8) 将离心管在冰上放置 5 min。
(9) 在 4℃ 下以最大速度离心 3 min 以除去细菌碎片。
2. 质粒的凝胶电泳分析
(1) 将上清依次转移到洁净离心管中。如果只用琼脂糖凝胶电泳分析样品,在每管中加入 0.4% 的溴酚蓝溶液;如果既要用琼脂糖电泳又要用 PCR 分析,则在样品中加入 2 μl 10 mmol/L 甲粉红。在 0.7% 的琼脂糖凝胶(5 mm 厚)的加样孔(5 mm 长,2.5 mm 宽)中加 50 μl 上清。
琼脂糖凝胶不含溴化乙锭,且所用的缓冲液也不含溴化乙锭,因为这样超螺旋 DNA 的迁移率比插入染料后更准确地反映其分子质量。这就能更容易地区分不同大小的质粒。
(2) 当溴酚蓝迁移到胶的 2/3 或 3/4 处,或甲酚红迁移到胶的一半时,室温下将胶浸在溴化乙锭溶液(0.5 μg/ml 的水溶液)中染色 30~45 min。在紫外灯下观察凝胶并拍照。
(3) 如果在 (1) 中使用甲酚红,则宜用 PCR 方法分析上清 ( 用各样品的剩余液作为模板 )。
甲酚红(Merk Index 公司)在酸性溶液中是橙色到琥珀色的,pH 为 7.2 时是黄色的,在碱性溶液中是红色的。与溴酚蓝和二甲苯蓝不同,甲酚红不抑制 DNA 聚合酶(Taq 聚合酶,从嗜热古细菌中提取)的热稳定性(Hoppe et al. 1992 )。因而,含甲酚红的 DNA 溶液在大多数扩增反应中可用。此染料在 2% 的琼脂糖凝胶中的迁移位于在二甲苯蓝和溴酚蓝之间,大小大约相当于 300 bp ( Hoppe et al. 1992 )。在琼脂糖凝胶电泳照片上,甲酚红不会产生像溴化乙锭染色一样的阴影。
(4) 将母板上可能含有重组子的菌落接种到含适当抗生素的 2 ml 液体培养基(LB、YT 或 SOB ) 中,进行小规模培养。
不需要等到母板上的菌落长到很大。细菌即使只是薄薄的一层,也足够接种用。
(5) 用此小规模培养物小量制备待测的重组子质粒。用酶切及琼脂糖电泳分析质粒 DNA,以确证其大小和结构与预期一致。