胎牛血清--细胞培养的困境
自从第一个在青蛙淋巴液中维持青蛙神经纤维的体外细胞培养实验以来,科学家们一直在寻找最佳培养基成分。多年来,开发了动物源性培养基和人工培养基。人工培养基的例子有Eagles培养基及其改良的Eagles培养基(MEM) 和Dulbecco的MEM (DMEM),以及Ham F10、F11和 F12。然而并非所有细胞都在这些人工培养基中繁殖。
1958年Theodore T. Puck首次引入了胎牛血清(FBS/FCS)来刺激细胞和组织培养中的细胞生长并发现细胞可以更长时间保持活跃生长在含有胎牛血清的培养基中。后来研究证明胎牛血清含有激素、维生素、转运蛋白、微量元素、扩散因子和生长因子等细胞增殖和维持的必需成分。自Puck发现以来,胎牛血清已被用作研究、生物技术和制药中人类和动物(包括昆虫)细胞培养基的通用补充剂。尽管可以使用其他来源的牛血清,如新生小牛血清、小牛血清和供体牛血清,但胎牛血清由于其免疫球蛋白和补体因子含量低而使用最广泛。尽管使用广泛,但胎牛血清在细胞培养中面临着诸多问题和风险。
伦理和安全
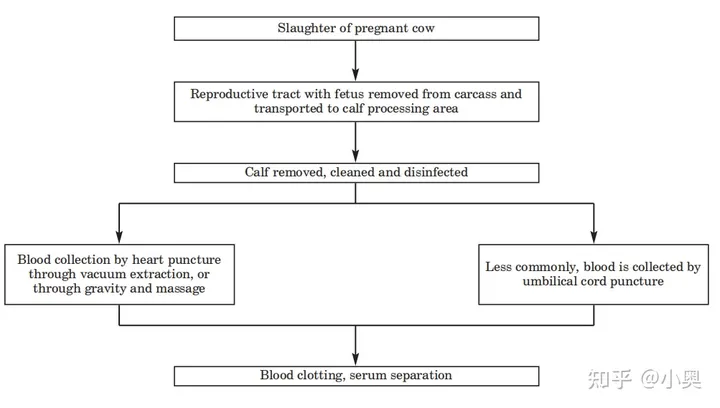
胎牛血清是从怀孕3-8个月母牛身上屠宰取出的牛胎中收获的,通常在没有任何形式麻醉的情况下通过心脏进行穿刺采集(图1)。为了最大限度地收集每头小牛胎儿的血液,需要通过注射器从跳动的心脏收集血液,胎儿可能会感到疼痛和/或不适,因此目前采集胎儿血液的做法是不人道的,这一做法引发了人们对动物福利的伦理担忧。据2012年数据统计显示,全世界每年生产约 800,000升胎牛血清,相当于 2,000,000头胎牛,而且数量一直增加。此外,胎牛血清作为动物源生物制品,可能携带支原体、病毒等传染性物质,一旦进入实验室,可能对实验人员安全造成威胁。因此,伦理和安全方面是开发和使用无血清培养技术的动机之一。
批次间较大的差异性
胎牛血清几乎是补充所有真核细胞培养基的首选。大多数细胞类型在增殖和活力方面似乎对胎牛血清反应良好。然而来自瑞士弗里堡大学 Adolphe Merkle 研究所 (AMI) 的生物纳米材料组和英国斯旺西大学医学院的体外毒理学组 (IVTG) 两个不同的实验室进行了体外实验,这些实验应用了相同的实验程序并使用了来自同一供应商的A549细胞和胎牛血清,他们得到的结果大不相同。进一步分析表明,细胞反应差异的一个原因是细胞培养基中添加了来自不同批次的胎牛血清。
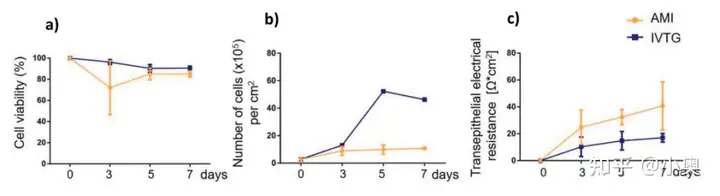
在不同地区和不同时间生产的不同批次的胎牛血清对细胞有不同的影响并不令人惊讶,因为它是一种生物制品,其成分在很大程度上是未知的。通过对细胞形态、生长速率和活力的影响,以及通过改变实验设置中的响应,这种差异可能在细胞培养中变得明显。当必须获得新批次的血清时,为了避免实验室内细胞性能的差异,需要进行费力的批次测试,以检查实验室中可用细胞系的内部质量标准。虽然这解决了内部不一致的问题,但没有解决实验室间的一致性问题,因为不同的实验室将无法获得同一批次的胎牛血清。当体外方法用于应用研究时,实验室间的可重复性变得至关重要,例如人体细胞的临床前研究,或用于药物和化学品的监管安全测试。由于这些实验室间的可重复性问题,经济合作与发展组织(OECD)于2017 年开始不鼓励使用胎牛血清。
自身生物活性影响
胎牛血清中含有多种未知成分,对细胞培养难免会引起一些其他的生物活性。例如已经有研究表明,胎牛血清可以抑制转化生长因子 (TGF)-β1 诱导的成纤维细胞样 B 型滑膜细胞中的软骨形成,抑制糖胺聚糖和类型 II 胶原蛋白的产生。全基因组微阵列分析显示,与自体(人)血清相比,胎牛血清 还被发现在人骨髓间充质干细胞 (hMSC) 中诱导更分化和更不稳定的转录,这表明其参与细胞周期的基因上调。此外胎牛血清中含有大量的牛外泌体和外源性细胞外囊泡等,当研究细胞自身分泌外泌体时,牛血清中的外泌体可能会造成严重的背景问题,从而影响或干扰结果的判断。
污染风险
大多数胎牛血清采用0.1uM的滤膜进行两次或三次无菌过滤而成,会从血清中去除较大的病毒,但无菌过滤仍然无法保证没有支原体和病毒。2002年有研究发现培养基支原体污染中的牛莱氏无胆甾原体和精氨酸支原体来源于牛血清。一旦细胞培养发生病毒污染,通常归因于细胞培养中所有的胎牛血清。
另外自1989 年以来,出现的传染性牛海绵状脑炎 (BSE,俗称疯牛病) 危机,也推动了临床或医药产品中替代牛源性材料的发展。由于非人类病原体的潜在污染、引发不良免疫反应的风险以及产品再现性问题,美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)不鼓励在细胞和组织培养的人类临床应用中使用胎牛血清 。
胎牛血清的替代物
出于实验风险和伦理安全的考虑,促使人们一直在寻找胎牛血清的替代物。在1980年,人血小板裂解物 (hPL) 被引入细胞培养。相比于胎牛血清,hPL有以下优点:
- 不存在异种免疫反应或牛病原体感染的风险;
- 制备方便:hPL通过冻融供体血小板浓缩物即可获得;
- 来源方便:据估计,50%~60%的供体血小板已经过期,可以将这些过期血小板用于hPL生产。关于hPL成功应用的文章数量正在稳步增加,未来hPL很可能作为细胞培养应用的普遍生长添加剂,成为胎牛血清的最佳替代品。
无血清培养基
无血清培养需要用使用安全且成分一致的培养基来替代胎牛血清培养基,因此人们越来越关注开发和使用化学成分确定的培养基。随着对培养基配方的不断优化,市面上已经出现了多种针对常规细胞的无血清培养基。例如奥浦迈针对CHO细胞和HEK293细胞推出多系列化学成分确定培养基,具备以下优势:
- 不含水解物、蛋白、生长因子及任何动物来源的成分
- 支持细胞的高密度悬浮培养和蛋白/病毒表达
- 高表达水平,目标蛋白表达量最高提升300%
- 优异的批次间一致性(RSD<5%)

- 符合GMP标准
- 稳定、快速供货
遗憾的是,目前仍然没有通用的化学成分确定的培养基,这意味着必须为每一个现有的细胞系开发出适合的化学成分确定的培养基。
展望
胎牛血清存在伦理安全问题,以及批次间差异性、污染等无法避免的风险,新型替代物(人血小板裂解物,hPL)以及无血清培养技术的发展为解决胎牛血清的问题带来了可行性方案,然后这些方案也存在其局限性。期待未来细胞培养技术的更多突破,更好的解决胎牛血清存在的风险和问题。
参考文献
[1] Jan van der Valk. Fetal bovine serum-a cell culture dilemma. Science. 2022 Jan 14;375(6577):143-144.
[2] Hana Barosova, et al. Inter-laboratory variability of A549 epithelial cells grown under submerged and air-liquid interface conditions. Toxicol In Vitro. 2021 Sep;75:105178.
[3] Jan van der Valk, et al. Fetal Bovine Serum (FBS): Past - Present - Future. ALTEX. 2018;35(1):99-118.
[4] Theodore T. Puck, et al. Genetics of somatic mammalian cells. III. Long-term cultivation of euploid cells from human and animal subjects. J Exp Med. 1958 Dec 1;108(6):945-56.




