平板菌落计数法-测定微生物数量实验
一、简介单细胞微生物个体生长时间很短,很快进入繁殖阶段,生长和繁殖难以分开,个体生长很难测定,而且实际应用意义不大,因此,它们的生长不是依据细胞大小,而是以群体
一、简介
单细胞微生物个体生长时间很短,很快进入繁殖阶段,生长和繁殖难以分开,个体生长很难测定,而且实际应用意义不大,因此,它们的生长不是依据细胞大小,而是以群体的生长作为单细胞微生物生长的指标。
二、操作方法
平板菌落计数法
三、原理
平板菌落计数法是根据微生物在固体培养基上所形成的一个菌落是由一个单细胞繁殖而成的现象进行的,也就是说一个菌落即代表一个单细胞。计数时,先将待测样品作一系列稀释,再取一定量的稀释菌液接种到培养皿中,使其均匀分布于平皿中的培养基内,经培养后,由单个细胞生长繁殖形成菌落,统计菌落数目,即可换算出样品中的含菌数。这种计数法的优点是能测出样品中的活菌数。此法常用于某些成品检定(如杀虫菌剂),生物制品检定以及食品、水源的污染程度的检定等。但平板菌落计数法的手续较繁,而且测定值常受各种因素的影响。
材料与仪器
大肠杆菌悬液
牛肉膏蛋白胨培养基
无菌吸管 平皿 试管 试管架
步骤
1. 编号:取无菌平皿9套,分别用记号笔标明10-4、10-5、10-6各3套。另取6支盛有4.5 ml 无菌水的试管,排列于试管架上,依次标明10-1、10-2、10-3、10-4、10-5、10-6。
2. 稀释:用1 ml 无菌吸管精确地吸取0.5 ml 大肠杆菌悬液放入10-1的试管中,注意吸管尖端不要碰到液面,以免吹出时,管内液体外溢。然后仍用此吸管将管内悬液来回吸吹三次,吸时伸入管底,吹时离开水面,使其混合均匀。另取一支吸管自10-1试管吸0.5 ml 放入10-2试管中,吸吹三次,其余依次类推。
3. 取样:用3支1 ml 无菌吸管分别精确地吸取10-4、10-5、10-6的稀释菌液0.2 ml,对号放入编好号的无菌培养皿中。
4. 倒平板:于上述盛有不同稀释度菌液的培养皿中,倒入溶化后冷却至45℃左右的肉膏蛋白胨琼脂培养基约10~15 ml,置水平位置,迅速旋动混匀,待凝固后,倒置于37℃温室中培养。
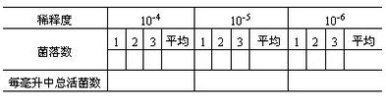
5. 计数:培养24小时后,取出培养皿,算出同一稀释度三个平皿上的菌落平均数,并按下列公式进行计算:
每毫升中总活菌数=同一稀释度三次重复的菌落平均数×稀释倍数×5
一般选择每个平板上长有30~300个菌落的稀释度计算每毫升的菌数最为合适。同一稀释度的三个重复的菌数不能相差很悬殊。由10-4、10-5、10-6三个稀释度计算出的每毫升菌液中总活菌数也不能相差悬殊,如相差较大,表示试验不精确。
平板菌落计数法,所选择倒平板的稀释度是很重要的,一般以三个稀释度中的第二稀释度倒平板所出现的平均菌落数在50个左右为最好。
平板菌蓓计数法的操作除上述的以外,还可用涂布平板的方法进行。二者操作基本相同,所不同的是涂布平板法是先将牛肉膏蛋白胨琼脂培养基溶化后倒平板,待凝固后编号,并于37℃温室中烘烤30分钟左右,使其干燥,然后用无菌吸管吸取0.2 ml 菌液对号接种于不同稀释度编号的培养皿中的培养基上,再用无菌玻璃刮棒将菌液在平板上涂布均匀,平放于实验台上20~30分钟,使菌液渗透入培养基内,然后再倒置于37℃的温室中培养。
6. 结果
将计数结果填入下表。