大肠杆菌菌液 PCR
原理
将菌体热解释放的 DNA 质粒为模板直接用于 PCR 反应扩增,鉴定目的片段。
用途
检验目的片段是否成功插入载体质粒。
材料与仪器
菌液
GoTaq® Green Master Mix(PCR 预混酶溶液、M7122、promega)或其他常规 PCR 试剂盒
无酶水、无菌枪头
目的片段扩增引物(或通用引物)
无菌无核酸酶的离心管
含固体培养基的平板、液体培养基
载体对应的抗生素
步骤
进行大肠杆菌菌液 PCR 的操作流程如下:
1、挑菌扩培:在超净工作台中,利用 10 μl 枪头挑取单克隆放入 300 μl 含相应抗性的液体培养基中,在摇床上 37 ℃,220 rpm 培养 3~4 小时即可取菌液进行 PCR;
2、将 GoTaq® Green Master Mix 从冰箱取出,混匀后瞬离,也可使用其他常规 PCR 试剂盒,按照说明书配制反应体系;
3、以下以 GoTaq® Green Master Mix 为例,按照下列表格配置 PCR 体系,同时需要设置阴性对照,阴性对照中的菌液换成无酶水。
| 10 ul 体系: | |
| 组分 | 体积 |
| GoTaq® Green Master Mix, 2x | 5 ul |
| 上游引物,10 uM | 0.5 ul |
| 下游引物,10 uM | 0.5 ul |
| 菌液 | 0.2 或 0.5 ul |
| 无酶水补充至终体积 | 10 ul |
4、将 PCR 管放入仪器进行 PCR 循环反应。
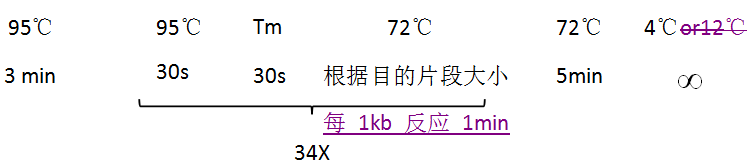
5、反应结束后,取 PCR 反应产物进行 1%~1.5% 琼脂糖凝胶电泳,在凝胶成像仪下观察并拍照,根据目的条带大小取阳性菌落送测序,测序结果比对目的条带序列以鉴定是否构建成功。
注意事项
1、在正式实验前,可以拿确定可行的质粒或者菌液样本进行预实验,探究最适 Tm 值和引物的效果。
2、进行菌液 PCR 时最好设置一个阴性对照,必要时设置阳性对照组(control),如果实验组没有出现条带或者条带位置不对,可以通过阴性和阳性对照组分析结果形成的原因,不必进行盲目重复实验来寻找原因。
问题思考方向:PCR 体系配置有问题,PCR 程序设置有问题,上下游引物不匹配或者是基因片段没有连到载体上等等。
3、菌液量不要过多或过少。PCR 是一个很灵敏的反应,微量的 DNA 模板都可以通过扩增得到目的条带。菌液是一个很复杂的溶液,里面含有培养基及各种细菌代谢产物,这些物质的量过多会影响甚至抑制酶的活力。如果觉得加入 0.2 μl 的菌液量不好吸取,可以将 1 μl 菌液稀释 10 倍后再取 0.5~1 μl 加入 PCR 体系。




