快速PCR在临床诊断及流行病调查中的应用
简介
快速PCR在临床诊断及流行病调查中的应用是在保证PCR反应特异性、灵敏度及保真性的同时,能尽量缩短反应时间的一种PCR方式。FastPCR技术开发的重要性在于不仅能在有限时间内使最初样品尽快得到扩增,还能同时增加被检测的样本数,这无疑对实现大批量样本检测、传染病快速诊断应急具有重要的保障。
原理
快速PCR在临床诊断及流行病调查中的应用的基本原理是与常规PCR相同,不同之处在于缩短每个步骤所需时间和温度转换时间,
提高PCR聚合酶的延伸活性、延伸速率必将缩短整个PCR反应所需时间。
用途
快速PCR可用于提高临床病例样本检测及诊断的效率、疾控现场应急操作、反恐生物标本检测和未来的生命科学领域。
材料与仪器
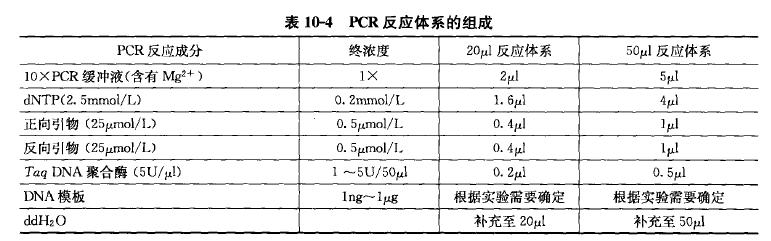
1.提取DNA步骤中所用材料:
MELTTM总核酸分离系统、Recover ALLM总核酸分离试剂盒等。
2.引物设计、Fast PCR扩增过程中所需的材料:
①Variant SEQr Resequencing System;
② AmpliTaq Gold Fast PCR Master Mix;
③MicroAmpFast 96- well Reaction Plates;
④VeritiM 96-well Fast Thermal Cycler;
⑤ExoSAP-IT 等。
3.快速循环测序中使用的耗材:
BigDye Terminator vl.1 Cycle Sequencing Kit、MicroAmp Fast 96 Well Reaction Plates、Ver-iti 96-Well Fast Thermal Cycler。
4.清除荧光标记的双脱氧终止子、dNTP及盐分等步骤中所用材料:
Centri-SepM柱子或96孔板、乙醇、BigDye XTerminatorTM Purification Kit。
5.最终对序列数据检测所用仪器:
毛细管电泳、3130 Genetic Analyzer。
6.数据分析中使用的软件:
Sequence Scanner v1. 0、Sequencing Analysis Software v5. 3. 1. KBIM Basecaller v1.4或Vari-ant ReporterTM Software等。
步骤
快速PCR在临床诊断及流行病调查中的应用的基本过程可分为如下几步:
A. PCR反应起始变性阶段。
PCR反应的第-步通常是在94~96 °C下变性(2~20 min): 该步骤将起初的模板变性而得到单链DNA,同时激活热启动PCR聚合酶。在实际操作中,94~95 °C 下反应2~3 min通常足以使全部的基因组DNA完全变性,即最初的变性步骤是直接的,实际所需时间很短。图12-10显示了运用iTaq热启动PCR聚合酶时,最初的DNA变性及聚合酶被激活时间仅需30 s甚至更短的时间。
B. PCR各反应循环中的变性步骤。
在之后的多个PCR反应循环中模板变性所需时间并非如反应起始变性步骤一样是直接进行的,因为后续循环中待变性的模板是之前循环结束所得的PCR产物片段,而这些PCR产物较最初DNA模板长度要短,且结构相对简单。已有实验证实:运用“iQM supermix"在92 ℃下变性ls即满足得到一系列不同的PCR产物的反应",该结论与1991年Yap和McGee[5]提出的:对于长度小于500bp的PCR扩增产物,并非需要变性温度在92 ℃以上相一致。
C.PCR反应经历的退火及延伸阶段。
基于大多数PCR反应中的DNA聚合酶在,经典的引物退火温度范围内(55~70 °C) 是维持高度激活状态的,PCR 流程中退火和延伸步骤通常被认为可看作较为简单的一个步骤。应用一或两步骤PCR操作规范而非标准的三步骤反应流程,就能使反应过程总体耗时有效地被缩短。
如果期望进一步缩短反应时间, 可通过减少上述退火、延伸联合步骤所需的反应孵育时间来实现。在多数实验中,标准操作流程的退火时间(15~60 s) 及延伸时间(1 min/kbPCR产物)是无需长时反应的。由于引物的浓度与模板高度相关,引物退火所需时间在最适反应温度下仅仅为几秒钟即可。
另外,运用iTaq聚合酶的最适反应体系能在更短的延伸时间内有效地扩增得到PCR产物。但是,优化退火及延伸温度是十分关键的,其很大程度.上决定了反应的特异性。
当退火温度过高时,引物不能有效地发生退火,可导致无扩增或产物量较低的现象;而如果退火温度过低,则引物的错配及非特异扩增又将是比较严重的问题,同时产物量将会减少。
为了尽可能地提高反应速度及优化反应特异性,在不影响PCR反应产量的情况下,通常考虑在尽可能高的退火温度下进行反应。热循环仪的温度梯度设计使退火温度的最优化能较易实现。
在Fast PCR体系中,为了建立常规的选择引物及退火、延伸温度的相关因素,这里推荐适宜应用的退火和延伸温度,其平均Tm值分布在58~72 ℃之间。图12-11显示:退火及延伸温度在一-定范围时Fast PCR较好的工作效率,在相应的最高退火、延伸温度下,引物参与的反应可获得总体最快反应速度。
注意事项:
通过对所用引物对简单地设计调整,可应用到Fast PCR反应体系中,从而取得较优化的反应引物Tm值。如果是现有引物对的Tm值较低,通常可在其序列5'端加入2~4个碱基从而适用于Fast PCR反应体系。当然,经修饰调整的新的引物对同样必须检测是否生成新的自身及相互的引物互补情况。
D.加快PCR热循环各温度阶段间温度改变的改进方法。
PCR热循环中不同孵育温度阶段间转换所需的时间会显著影响反应的总时间。采用快速传热的PCR循环仪或增加热传导速率都可能提高不同温度阶段间升温或降温的速率,从而实现FastPCR目的。
传统的以金属基座加热的PCR循环仪传热效率提高的可能性较小,而采用空气动力学模式的PCR仪则允许对升温、降温空气温度进行很大程度上的调整,PCR样品管也可换为导热率更高的材料,如毛细玻璃管代替塑料。
Roche公司研制的LightCyclerTM荧光定量PCR系统,即采用处于离心状态的毛细玻璃管作为样品管,在样品管扩增时处于离心状态,有利于样品温度的均匀性,同时也有助于加强空气流动,增强导热能力。
另外,可以利用涡管端口间压力差将室温空气分为冷、热两种气体,热气体能用于反应DNA变性所需,温度控制由涡管压力升降控制,通过开放阀门能调整冷热空气混合比例,从而得到理想的预定温度空气流。对于传统的PCR仪加热方式,也有研究者作出了相应的调整:尝试红外线加热,并在实际应用中得到肯定。利用红外线进行加热,同时通过大量吸入外来冷空气实现冷却步骤。
E.最终的延伸阶段。
标准的PCR反应流程在最终的孵育阶段为72 °C5~10 min,该步骤通常认为是能促进完整地合成全部PCR产物的关键所在。尽管该步骤大多是作为一个延伸的步骤,而实验主要的目的则在于使PCR产物重退火形成双链DNA,在凝胶电泳后或是用于克隆过程时加入溴化乙锭,能使其显影。研究发现:对于形成长度在100~1000 bp的PCR产物来说,该步骤的耗时能缩短至30~60 s (如图12-12所示)。
F.PCR反应的循环次数。
当反应起始时如果靶分子浓度较高,则PCR反应能经历相对较少的反应循环次数即可完成。而当反应起始时目的DNA拷贝数较低时,通常认为35个循环才适宜在一块含溴化乙锭的凝胶上检测反应产物。如果反应起始时靶分子浓度很低,则需增加一-些反应循环次数。在实际操作中,通常靶分子的量是未知的,且每个反应大多仅有几百个拷贝数。因此,研究人员常选择30~45个PCR反应循环而并非为了缩短反应总时间采用较少的循环次数。
注意事项:
1.对于PCR产物小于250 bp的反应,可对操作流程做如下修改以加快PCR循环的进行:
①选择退火温度Tm值在64~69 °C的引物(按照Santa Lucia最近邻界热力值计算);
②将起始模板变性步骤(Taq 酶激活步骤)控制在98 °C,持续30 s;
③将每个循环变性温度控制在9undefinedC 1s。
④将退火与延伸两步合并为一个简单的步骤,温度在70C 20 s。
通过上述操作流程的改进,运用标准PCR循环仪(如Bio Rad thermal cyclers )及反应所需容器和试剂,可将循环反应所需时间减少(如图12-13所示)。
2.对于150~250 bp的PCR产物,反应时间能从1. 5 h减少到34~37 min。对于1000 bp左右的PCR产物,能将反应用时从2 h减至34 min左右。SYBR green实时定量PCR通常用时33 min即能完成。
注意事项
1. 采用Fast PCR技术对目的DNA片段进行扩增,应考虑Fast PCR对较长PCR产物的适用性。
2. 常规FastPCR操作方法推荐。为了更好地提升PCR反应速度,操作者应对照下列各项提示,考虑所采用的PCR反应操作流程、反应体系中各试剂的应用及目的PCR产物片段的大小。
(1) Fast PCR推荐体系反应参数 利用模板加热变性的起始温度在98 °C 30 s; 随后进行35个循环的变性、退火及延伸步骤,各步骤温度及时间设置如下92 °C 1 s或70 °C15s,72 °C 1 min.
(2)调整对退火及延伸温度的设置将退火及延伸的温度设定为引物的平均退火温度与72 °C的平均值,例如,如果平均引物退火温度为58 °C,则适宜将退火及延伸温度设定在65 °C左右。
(3)如果Fast PCR反应起始时目的片段数在100个拷贝以下建议重复 40个反应循环。
3. Fast PCR技术优化策略:
(1)对于目的扩增片段小于1 kb的反应可应用一种抗体介导的热启动酶如iTaq; 而对于目的产物片段大于1 kb的试验来说,适于应用iProof聚合酶。
(2)如果使用现成的引物对需 核对所进行的反应的Tm值是否在58~72 °C之间;如果针对不同的反应设计新的引物,最好将Tm值调至70 °C上下。
(3)产物片段长度在20 kb以下的反应均适于采用上述推荐的FastPCR操作指南的相关规则,而对于用时很短的快速反应,则大多要求目的片段的大小要小于250 bp,否则很难实现。
(4)其它相关FastPCR操作推荐策略通过对反应流程各关键步骤的简单调整即可在很大程度上优化PCR反应过程,从而实现较快的不同温度转换变化,节省更多的反应耗时,使整个PCR反应流程时间缩短(见表12-2)。
①反应起始时,在最初的PCR反应模板加热步骤中将反应温度调至98 °C持续30 s,随后温度下调至92 ℃ 1s,XX °C (温度梯度) 15 s反应重复35个循环;然后再将温度调至72 °C持续1 min。
②将①中的温度梯度进行调节,例如,设定在引物Tm值以上0~10 °C左右,以使用尽可能高的退火及延伸温度。
常见问题
常见问题 1
问题表现:电泳检测FastPCR产物凝胶条带较弱。
可能原因:退火及延伸温度的时间、温度不合适.
解决方案:适当延长反应的退火及延伸温度的时间(5s左右),降低退火/延伸温度2~4℃,提高变性温度1~2℃等。
常见问题 2
问题表现:非特异条带较明显。
可能原因:退火及延伸温度、引物设计有问题。
解决方案:提高退火及延伸温度2~4℃;考虑重新设计PCR引物对,使其T值升高2~4℃;或选择目的片段的另一段区域进行PCR扩增。