离体神经突触的代谢性标记实验
材料与仪器
步骤
一、放射自显影
神经元在条件培养基中培养 2d,如第十章所述。
1.用一个锋利的微电极从胞体分离神经突起,并用牵引电极将胞体移出培养皿 (见第十章)。
2.在培养液中加入终浓度 0.lmmol/L 氯霉素,阻断线粒体蛋白的合成。
3.小心移去培养液并用温育液洗涤 6 次,每次 Imin。保证轴突始终被一小部分液体覆盖;一旦干了,轴突便会崩解。
4.在含 0.5mCi/ml 反式-35S 和 0.1 mmol/L 氯霉素的温育液内标记 30 min。
5.用含 lmol/L 未标记半胱氨酸和蛋氨酸以及 0.1_d/L 氯霉素的温育培养液洗漆 6 次,每次 40 min。
6.用 1% 的多聚甲醒和 1% 的乙酸固定 2 h。
7.用一系列浓度递增乙醇脱水。
8.于空气中干燥。
9.浸入放射自显影乳剂。
10.曝光 2~7 山具体时间根据 35S 标记掺入蛋白的速度而定。
11.D19 中显影。
12.水中短暂漂洗。
13.20%Na2S2O3(硫代硫酸钠)水溶液固定。
14.水洗漆 20 min。
15.封片液或甘油封片。
二、聚丙烯酰胺凝肢电泳
1.从胞体分离神经突起并去胞体。
2.0.1 mmol/L 氣霉素预温育分离的神经突起 30 min。
3.用温育液洗漆 6 次,每次 Imin。
4.在含 0.5mCi/ml 反式-35S 和 0.1 mmol/L 氯霉素的温育液内标记 2.5 h。
5.温液洗涤 6 次,每次 30 min。
6.20ul SDS 样本缓冲液收集神经突起,并转移入微量离心管。
7.煮沸 5 min。
8.样本于 12OOOr/min, 离心 2 min。
9.取上清液加样到 8% SDS-PAGE 进行电泳。
10.50% 甲醇和 10% 乙酸固定凝胶 30 min。
11.用扩增仪处理凝胶 20 min。
12.千燥凝胶。
13.在 X 射线胶片(KodakBiomaxMS) 上曝光 1~3 周。
14.显影胶片
三、结果
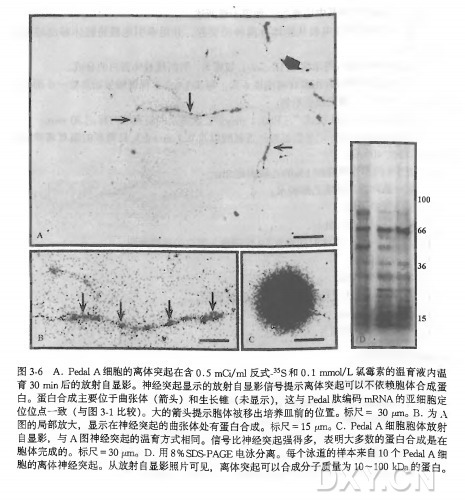
为了解神经突起内蛋白的合成部位以及这些部位合成蛋白的异质性,我们应用反式-35St 示记技术通过 35S 标记的半胱氨酸和蛋氨酸标记了离体神经突起。如果离体轴突确实存在蛋白合成,那么这些放射标记的氨基酸将能够掺入蛋白,并被放射自显影方法检测到。结果证明神经突起能够合成各种各样的蛋白,而且这个过程主要发生在曲张体和生长锥(图 3-6)。