电镜原位杂交技术实验
原理
作为替代,可以用过氧化物酶交联和超微金交联物(<lnm)。过氧化物酶可以用二氨基联苯胺显色,但缺点是分辨率太低,且不能对反应产物定量。超微交联物则太小而不能在显微镜下直接观察到,必须通过银染増强后才能被看见(Danscher1981),但这一过程又可能产生一些大小不规则的银颗粒,从而妨碍目标物的准确定位。而且,已有报道银染增强能对超微结构产生负面影响(Eggeretal.1994;Macvilleetal.1995)。
因此,相对而言,后包埋杂交技术是更好的方法,它既能保持良好的超微形态结构又具有合理的敏感性。由于只是切片的表面被标记,还可以用较大金交联物来显示杂交探针。亲水树脂(如 LowicrylK4M、HM20、LRWhite、LRGold 以及 Bioacryl) 明显优于传统的 EM 包埋剂(如 Epon 和 Araldite),因为前者的亲水性大大增强了探针接近靶核酸序列的能力。有些非包埋方法,如常常提到的冰冻切片技术,则结合了前包埋和后包埋两种方法的优点,即探针接近靶核酸序列的能力高和超微结构的良好保持。但是这种方法也有缺点,如所需设备昂贵,要有熟练的技术人员去操作,而且,切片对变性处理非常敏感,以至于会造成部分超微结构和靶核酸序列的丢失。上述三种方法的选择取决于研究者的需要和样本的情况,应当根据具体情况分别对待。这三种方法的优缺点已总结在表 3-1 中。以我们的经验来看,非包埋法在敏感度和超微结构的保持上结果最好。而且,在操作过程中可以很容易地与免疫细胞化学相结合,用以在相同的切片中鉴定其他物质(如神经肽等)。我们已经利用该技术来研究软体动物神经元中编码神经肽的 mRNA 在轴突部分的超微结构定位。

材料与仪器
配比溶液
冷冻超薄切片机 电子显微镜 镍 网(75目)
步骤
一、超薄冰冻切片的组织固定
1.用干净的玻璃器皿或者一次性器皿配制固定剂
2.用新鲜配制的固定剂
3.2%~4% 的多聚甲醛和0.2% 戊二醛固定组织。戊二醛对于确保良好的超微结构是必要的。然而由于固定剂的交联特性,更高浓度(>0.5%) 则严重阻碍探针的穿透。因此,对于要用于研究的毎个样本,必须在超微结构保持和探针穿透性之间找到平衡点。
二、固定和样本制备
小块组织采用浸泡固定。对于大的组织,如大鼠的脑,建议用灌注固定法。
1.过浸泡固定小块组织,4℃ 过夜。
2.Imol/L 磷酸盐缓冲液洗涤组织 2 次,每次 10 min。
3.用含有 0.15% 甘氨酸的 0.1mol/L 磷酸盐缓冲液洗涤 2 次,每次 10 min。用含 2.3mol/L 的蔗糖 PBS 液浸泡组织至少 4 h,在浸泡时持续滚动小管子。
三、标本制备
在切片前将组织块固定在标本支持物上;我们一般用铜钉固定。
1.用砂纸将钉子表面打粗糙。
2.洗涤钉子以去除小的金属碎片。
3.用 70% 乙醇洗涤钉子并用吸水纸干燥。
4.从蔗糖溶液中取出组织并用解剖显微镜将组织定位于钉子上。. 用吸水纸吸去过多蔗糖。
5.用干净的镊子把带样本的钉子放入液氮。
6.在液氮中储存样本直至使用
四、切片
1.把组织样本从液氮罐转移至超薄切片机时,应确保没有融化。
2.超薄冰冻切片的理想温度为 100~120℃。
3.用干刀完成切片。
4.常做一个厚切片(500nm) 用来定位组织以及检查固定效果。这种厚切片能用 1% 甲苯胺蓝溶液染色。
5.细修剪标本边缘能改善超薄切片质量。可用剃须刀片或者玻璃刀完成。
6.对于薄切片(40~80nm),建议使用金刚石刀。
7.用接种环把切片从刀片上分离下来。这种接种环是一个 I5 cm 的塑料把手接了一个小金属套圈(直径 2 mm),金属套圈充满 2.3md/L 蔗糖或是蔗糖/甲基纤维素混合液。
8.用接种环收集切片后,让它们短暂解冻,并立即转移到筛网上。
9.用蔗糖/甲基纤维素混合液收集切片有两个优点,一是形态结构保持得更好更完整,二是筛网在冰箱中至少能储存 3 个月。
10.用透明塑料包被或碳包被的镍网;铜网在处理过程中会氧化,形成肮脏的沉淀,从而干扰电镜成像。
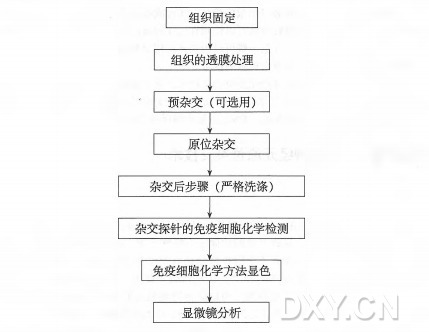
五、电镜原位杂交步骤
将筛网(切片面朝下)放到含有 2% 明胶溶液的带盖培养皿上,在电热板上 (37℃) 放置 5 min,然后在 37℃ 孵箱内放置 20 min。
以下步骤都在小滴液体中完成。将小滴试剂(探针和抗体溶液用 5~10ul, 洗涤用 100ul) 点在封口膜蜡上,把筛网切片面朝下放在小滴上。
该方法选用了蛋白 A-金交联物。因为蛋白 A 与兔 IgG 的亲和力高,而与羊 IgG 的亲和力低,抗地高辛抗体多为山羊抗体,所以采用兔抗山羊二抗作信号放大的中介。
1.于 0.15% 甘氨酸的 PBS 温育 2 次,每次 5 min。
2.用 2XSSC 温育 2 次,每次 5 min。
3.在无探针的杂交缓冲液中预杂交 20 min。
4.加 O.Ig 探针液到 10ul 杂交混合液。
5.杂交筛网放入一个密闭容器中,同时放入湿滤纸以防杂交缓冲液蒸发,于 50C 置 3 h。
6.用 2XSSC 温育 Imin。
7.用 50% 甲酰胺和 2XSSC 混合液洗涤 2 次,每次 5 min。
8.在密闭和湿化的容器中,于 50°C 用 50% 甲酰胺/2XSSC 混合液严格洗涤 3 次, 每次 20 min。
9.用 2XSSC 洗涤 2 次,每次 5 min。
10.用含 I%BSA 的 PBS 洗涤 3 次,每次 5 min。
11.用含有 1% 鱼明胶的 PBS 洗涤 lOmin。
12.在山羊抗地高辛抗体(1:100 稀释于含 1% 鱼明胶的 PBS) 中室温下温育 Ih 或者 4C 过夜。
13.用含有 1% 鱼明胶的 PBS 洗涤 5 min。
14.用含有 1%BSA 的 PBS 洗涤 3 次,每次 10 min。
15.用含有 1% 鱼明胶的 PBS 洗涤 5 min。
16.在兔抗羊抗体(1:100 稀释于含 1% 鱼明胶的 PBS) 中温育 30 min。
17.用含有 1% 鱼明胶的 PBS 洗涤 5 min。
18.用含有 1%BSA 的 PBS 洗涤 3 次,每次 10 min。
19.在蛋白 A-胶体金交联物(稀释于 1%BSA 的 PBS,稀释比例依据使用说明)中温育 20 min。
20.PBS 洗涤 3 次,每次 15 min。
21.在含 1% 戊二醛的 PBS 中固定 10 min。
22.PBS 洗涤 5 min。
23.蒸馏水洗涤 5 次,每次 Imin。
24.在 2% 乙酸双氧铀液中温育 5 min。
25.用乙酸双氧铀/甲基纤维素洗涤 2 次,每次 Is。
26.将切片包埋于乙酸双氧铀/甲基纤维素中,置冰上 10 min。
27.用接种环从甲基纤维素液体小滴上移去筛网。
28.用滤纸去除过多的甲基纤维素,将筛网留在接种环上并让它风干 30 min。
29.转移筛网到筛网盒中
六、免疫细胞化学
电镜原位杂交(EM-ISH) 与免疫细胞化学组合十分方便,在上述第 22 步后,接用以下方法:
1.用含有 0.15% 甘氨酸的 PBS 洗涤 3 次,每次小于 10 min。
2.用含 1% 鱼明胶和 I%BSA 的 PBS 洗涤 5 min。
3.与抗体(兔抗,稀释于 1% 鱼明胶和 1%BSA 的 PBS) 温育 45 min。
4.用含 I%BSA 的 PBS 洗涤 5 次,每次 Imin。
5.与蛋白 A-胶体金交联物(稀释于 1%BSA 的 PBS) 温育 20 min,可采用不同大小的金比较 ISH 信号的显示。
6.下接电镜原位杂交方法的第 20 步。
七、结果
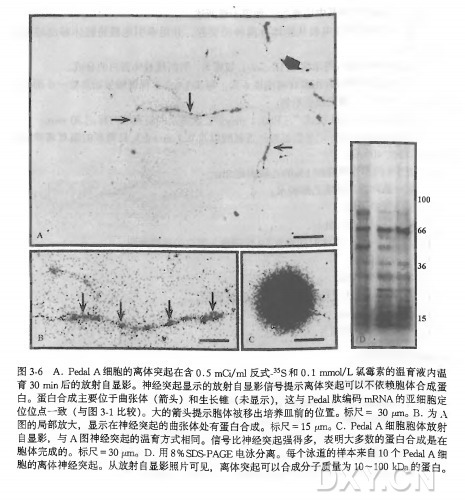
以往的研究已经显示,在软体动物椎实螺,能合成卵生激素(ELH) 的神经元的轴突内含有大量编码 ELH 的 mRNAVanMinnen1994)。我们用 EM-ISH 研究这些编码神经肽的 mRNA 的超微结构定位。首先,我们研究了 ELH 转录物在合成 ELH 神经元胞体内的定位。正如所料,发现它们主要与粗面内质网膜相关(图 3-2A)。其他细胞器中(如线粒体、高尔基体、分泌囊泡)则没有显示 ELH 转录物的存在,这一点可以从图 3-4 中观察到,上述细胞器并未出现 ISH 信号(小金颗粒)和 ELH 免疫反应性物质(大金颗粒)的共定位。然后,我们研究了 ELH 转录物在神经元轴突内的精确定位,发现它们主要位于轴浆中(图 3-3), 在含有 ELH 的核致密囊泡中则没有其转录物的存在,这一点与以前的报道相符(Dirks1996)。
在实验中,我们主要观察了编码 ELHmRNA 的超微结构定位,同时也发现山羊抗地高辛抗血清能与含有 ELH 的核致密囊泡交叉反应。为了避免这一问题,我们使用了鼠抗地高辛单克隆抗体(步骤 12), 然后在第 16 步用兔抗鼠抗体来替代原来使用的兔抗羊抗体。以上数据进一步说明做 ISH 时设立正确对照实验的必要性。

注意事项
杂交与预杂交的温度可以是55到60度不等,温度越低,探针结合越好,温度越高,背景越小。
来源《现代神经科学研究技术》作者:U.Windhorst & H. Johansson 翻译:赵志奇 陈军
常见问题
此方法有很高的敏感性和特异性,可进一步从分子水来探讨细胞的功能表达及其调节机制。已成为当今细胞生物学、分子生物学研究的重要手段。