应用混合寡核苷酸引物引导的cDNA扩增(MOPAC)
原理对于仅仅知道某种蛋白质的部分序列,而要克隆其基因的最佳方法是,利用已知氨基酸序列设计相应的寡核苷酸,用此寡核苷酸作为探针去筛选基因文库钓取全长基因或者用寡核
原理
对于仅仅知道某种蛋白质的部分序列,而要克隆其基因的最佳方法是,利用已知氨基酸序列设计相应的寡核苷酸,用此寡核苷酸作为探针去筛选基因文库钓取全长基因或者用寡核苷酸作为引物进行 PCR 扩增靶基因。这两种方法都会遇到寡核苷酸所编码的遗传密码子的简并性问题。
材料与仪器
热稳定 DNA 聚合酶 DNA 模板 反义寡核苷酸库 正义寡核苷酸引物库
扩增缓冲液 dNTP 贮存液
聚丙烯酰胺凝胶 屏蔽型枪头 离心管 正向排液式移液器 PCR 仪
扩增缓冲液 dNTP 贮存液
聚丙烯酰胺凝胶 屏蔽型枪头 离心管 正向排液式移液器 PCR 仪
步骤
一、材料
1. 缓冲液与溶液
10X 扩增缓冲液
4 种 dNTP 贮存液(20 mmol/L,pH 8.0 )
2. 酶与缓冲液
热稳定 DNA 聚合酶
3. 凝胶
聚丙烯酰胺凝胶
4. 核苷酸与寡核苷酸
DNA 模板(100 μg/ml,基因组 DNA 或 cDNA 基因文库)溶于 TE 中(pH 8.0)
反义寡核苷酸库(10 μmol/L)溶于 TE 中(pH 8.0)
正义寡核苷酸引物库(10 μmol/L)溶于 TE ( pH 8.0)
5. 特殊设备
自动微量移液器的屏蔽型枪头
离心管(0.5 ml,薄壁扩增反应专用离心管)
正向排液式移液器
PCR 仪
二、方法
1. 按以下次序,将各成分加入到一只 0.5 ml 灭菌离心管、扩增管或灭菌微量滴定板的孔内,混合:
0.5 μg 模板 DNA 5 μl
10X 扩增缓冲液 5 μl
20 mmol/L 4 种 dNTP 混合液(pH 8.0) 5 μl
10 μmol/L 正义引物库(70 pmol) 7 μl
10 μmol/L 反义引物库(70 pmol) 7 μl
1~2 单位热稳定 DNA 聚合酶 1 μl
H2O 补足至 50 μl
设置几支对照反应管。在一只对照管中加入除了模板 DNA 外的所有上述试剂。第二支加入除去一种引物以外的所有上述试剂。
2. 如果 PCR 仪没有配备加热盖,在反应混合液的上层应加一滴矿物油(约 50 μl),防止样品在 PCR 反应多个加热与冷却的循环过程中蒸发。如果应用热启动 PCR 程序,在反应混合液的上层加一层石蜡油。放置离心管和微量滴定板在 PCR 仪上。
3. 按以下方法进行 PCR 扩增。典型的程序有变性、复性和聚合(延伸反应);相应的循环条件与温度列表如下:
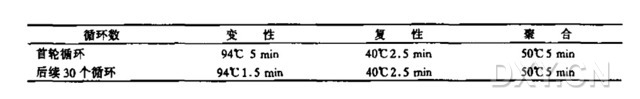
4. 抽取每种扩增样品 5~10 μl 用琼脂糖凝胶电泳或聚丙烯酰胺凝胶电泳来分析扩增结果,用 DNA marker 来判断扩增片段的大小。凝胶一般用 EB ( 溴化乙锭)或 SYBR 金颗粒染色后来观察扩增的量与片段大小。
如果针对一条连续氨基酸序列设计正义和反义引物用于 MOPAC 反应,目的扩增产物的大小将是已知的。在大多数情况下,薄层聚丙烯酰胺凝胶(<6%) 可用于能分辨核苷酸序列大小的分级分离使目的产物获得明确的鉴定。一种鉴定方法为扩增产物能被末端标记和进行其化学序列分析确定与两套寡核苷酸库相结合的一条惟一的序列。这种惟一序列最终能被合成和用于作为分离与筛选更长的 cDNA 基因的探针。另一种可供选择的方法是,MOPAC 产物自身在第二轮 PCR 中被标记和用作探针。如果酶切位点被设计在起始寡核苷酸引物的 5' 末端,因而这种扩增片段经相应的内切酶清化后易于克隆到相应的质粒或噬菌体载体上。
5. 若用矿物油覆盖在微量离心管内样品液体的上层,反应结束后可用 150 μl 氯仿抽提去除。
在 PCR 反应管内,包含扩增 DNA 片段的水相与上层矿物油的界面形成弯月面,在弯月面下面的水相还有微胶粒。可用自动移液器小心吸取水相液体转移到一个新的离心管内。
为了许多目的,如用 Cemricon 微量浓缩器纯化扩增 DNA 片段,或者克隆扩增产物,在进行实验操作前去除反应管上层的油相是必要的。


1. 缓冲液与溶液
10X 扩增缓冲液
4 种 dNTP 贮存液(20 mmol/L,pH 8.0 )
2. 酶与缓冲液
热稳定 DNA 聚合酶
3. 凝胶
聚丙烯酰胺凝胶
4. 核苷酸与寡核苷酸
DNA 模板(100 μg/ml,基因组 DNA 或 cDNA 基因文库)溶于 TE 中(pH 8.0)
反义寡核苷酸库(10 μmol/L)溶于 TE 中(pH 8.0)
正义寡核苷酸引物库(10 μmol/L)溶于 TE ( pH 8.0)
5. 特殊设备
自动微量移液器的屏蔽型枪头
离心管(0.5 ml,薄壁扩增反应专用离心管)
正向排液式移液器
PCR 仪
二、方法
1. 按以下次序,将各成分加入到一只 0.5 ml 灭菌离心管、扩增管或灭菌微量滴定板的孔内,混合:
0.5 μg 模板 DNA 5 μl
10X 扩增缓冲液 5 μl
20 mmol/L 4 种 dNTP 混合液(pH 8.0) 5 μl
10 μmol/L 正义引物库(70 pmol) 7 μl
10 μmol/L 反义引物库(70 pmol) 7 μl
1~2 单位热稳定 DNA 聚合酶 1 μl
H2O 补足至 50 μl
设置几支对照反应管。在一只对照管中加入除了模板 DNA 外的所有上述试剂。第二支加入除去一种引物以外的所有上述试剂。
2. 如果 PCR 仪没有配备加热盖,在反应混合液的上层应加一滴矿物油(约 50 μl),防止样品在 PCR 反应多个加热与冷却的循环过程中蒸发。如果应用热启动 PCR 程序,在反应混合液的上层加一层石蜡油。放置离心管和微量滴定板在 PCR 仪上。
3. 按以下方法进行 PCR 扩增。典型的程序有变性、复性和聚合(延伸反应);相应的循环条件与温度列表如下:

4. 抽取每种扩增样品 5~10 μl 用琼脂糖凝胶电泳或聚丙烯酰胺凝胶电泳来分析扩增结果,用 DNA marker 来判断扩增片段的大小。凝胶一般用 EB ( 溴化乙锭)或 SYBR 金颗粒染色后来观察扩增的量与片段大小。
如果针对一条连续氨基酸序列设计正义和反义引物用于 MOPAC 反应,目的扩增产物的大小将是已知的。在大多数情况下,薄层聚丙烯酰胺凝胶(<6%) 可用于能分辨核苷酸序列大小的分级分离使目的产物获得明确的鉴定。一种鉴定方法为扩增产物能被末端标记和进行其化学序列分析确定与两套寡核苷酸库相结合的一条惟一的序列。这种惟一序列最终能被合成和用于作为分离与筛选更长的 cDNA 基因的探针。另一种可供选择的方法是,MOPAC 产物自身在第二轮 PCR 中被标记和用作探针。如果酶切位点被设计在起始寡核苷酸引物的 5' 末端,因而这种扩增片段经相应的内切酶清化后易于克隆到相应的质粒或噬菌体载体上。
5. 若用矿物油覆盖在微量离心管内样品液体的上层,反应结束后可用 150 μl 氯仿抽提去除。
在 PCR 反应管内,包含扩增 DNA 片段的水相与上层矿物油的界面形成弯月面,在弯月面下面的水相还有微胶粒。可用自动移液器小心吸取水相液体转移到一个新的离心管内。
为了许多目的,如用 Cemricon 微量浓缩器纯化扩增 DNA 片段,或者克隆扩增产物,在进行实验操作前去除反应管上层的油相是必要的。







