变性聚丙烯酰胺凝胶的制备实验
材料与仪器丙烯酰胺溶液 过硫酸铵水溶液 去离子水 去污剂 乙醇 KOH 甲醇溶液 聚硅氧烷溶液 TBE 电泳缓冲液 TEMED 尿素弹簧夹 干胶架 封胶带 胶板
材料与仪器
丙烯酰胺溶液 过硫酸铵水溶液 去离子水 去污剂 乙醇 KOH 甲醇溶液 聚硅氧烷溶液 TBE 电泳缓冲液 TEMED 尿素
弹簧夹 干胶架 封胶带 胶板(配对的) 和隔板 手套 凡士林 保护性的工作合纸 鲨鱼齿梳子 有臂的烧瓶 隔板 注射器 试管架
弹簧夹 干胶架 封胶带 胶板(配对的) 和隔板 手套 凡士林 保护性的工作合纸 鲨鱼齿梳子 有臂的烧瓶 隔板 注射器 试管架
步骤
材料
缓冲液和溶液
参照附录 1 配制贮存液、缓冲液、试剂。稀释贮存液到适当的浓度。
丙烯酰胺溶液(45%m/V)
丙烯酰胺(DNA 测序级) 434 g
N,N'-亚甲双丙烯酰胺 16 g
加水 至 600 ml
加热至 37°C 以促进溶解用蒸馏水调至 1 升,用硝酸纤维素膜过滤(孔径 0.45ptn). 室温贮存于棕色瓶中。另外一种较为昂贵的方法是购买预先混合好的丙烯酰胺: 双丙烯酰胺粉末,再用水溶解。便宜的丙烯酰胺: 双丙烯酰胺粉末通常混合有金属离子。由此配置的贮存液需要纯化,方法是,与 0.2体积的树脂(MB-1,Mallinckrodt) 混合搅拌,再用 Whatmenl 号纸过滤。贮存中,丙烯酰胺: 双丙烯酰胺会缓慢的变成酸性,这个脱氮基过程由光和碱催化。保持溶液 pH 值在7.0 或者以下,在黑色瓶中保存于室温应该每几周重配一次。
过硫酸铵水溶液(1.6%m/V)
去离子水
去污剂
乙醇
KOH/甲醇溶液
在 100ml 甲醇中加入 5 gK0 H 配成,用于清洗玻璃板,贮存在密闭的玻璃瓶中。
聚硅氧烷溶液
传统的聚硅氧烷溶液中包括二氯二甲基硅,它有毒性、挥发性并且易燃。近年来,出现了一些无毒的替代物,包括 Gel Slick(FMC Bioproducts)、RainX(Unelko,Scottsdale Arizona), 和 Acrylease(Stratagene)。
10XTBE 电泳缓冲液
TBE 在聚丙烯酰胺凝胶电泳时的浓度是 lx(89 mmol/L Tris-硼酸,2 mmol/L EDTA),这一浓度是琼脂糖电泳用量的 2 倍(请见第 5 章)。用于聚丙烯酰胺凝胶电泳的垂直电泳槽的缓冲液池一般较小,故所通过的电流量通常相当大。要用 lxTBE 才能够保证适当的缓冲容量。缓冲液的 pH 值应接近8.3。一般无须调 pH 值;可是,对于每次新配的 10XTBE 电泳缓冲液都要认真检査 pH 值。
使用同样的 10xTBE 电泳缓冲液配制胶和工作缓冲液,因为两者之间微小的差异也会导致 DNA迁移时严重扭曲。
使用氨基乙磺酸(36 g/L 的 10XTTE 缓冲液) 取代标准 TBE 溶液中的硼酸可以减少由于形成甘油-硼酸阴离子脂类化合物而导致的在胶的顶部的条带扭曲<Pisa-Willanson and Fuller1992)。若需要更多的信息请参见 DNA 测序反应中的甘油一节。
TEMED(N,N,N',N'-四甲基乙二胺)
电泳级的 TEMED 在很多公司有售(Sigma,Bio-Rad),TEMED 容易吸潮,必须 4°C 贮存在密闭的瓶中。它是聚合反应中的连接催化剂。
尿素,固体
特殊装置
弹簧夹:5 cm 长,每块胶 5 到 7 个。
干胶架
虽然不重要,干胶架对于干燥和贮存测序用的玻璃平板是非常方便的(Bio Whitraker)。
封胶带
例如 3M Scotch Stretchable Tape(Lab Safety Supply,Janesville,Wisconsin),3M Scotch yellow electrical tape#56(Life Technologies),3M Scotch polytetrafluorethylene(PFTE)extruded film tape。关于不同种胶带的用法和其他封胶的方法,参见 Hengen(1996)。
胶板(配对的) 和隔板
制胶的板一块比另一块略长 3.5-4.0 cm, 或者有一块板是缺刻的。为避免胶板裂了或者漏了,最好保持板是配对的并且和测序胶的槽相对应。
手套
无滑石粉、易处理的橡胶或者聚氯乙烯(PVC)。
凡士林
可选择,见步骤 4
保护性的工作合纸
一面是塑料的(Kaydry Lab Cover from Fisher) 或者 Benchkote。
鲨鱼齿梳子
0.4 mm 厚,32,64 或 96 齿. 依赖电泳装置的能力。
有臂的烧瓶(250 ml)
隔板(厚度一致或者边缘较窄)
每胶两板,由有弹性的薄塑料板(0.4 mm) 或特氟隆(Sanger and Coulson 1978) 制成,使玻璃板隔开。在胶板和隔板之间形成不透水的封口,使未凝固的胶溶液不会漏出。
边缘窄的隔板用于制造底部比顶部厚的胶,使底部的条带比较窄并且整块胶的条带比较均匀。虽然它有这样的优点,但是比较难以制备和干燥。
注射器(60cc)
可选择,见步骤 15.
试管架
55°C 水浴
方法
重要:为防止皮肤油脂的污染. 必须一直带无滑石粉的手套,并且只能拿板的边沿。
准备胶板
1. 必要时,甩 KOH/甲醇清洗板上的旧污渍。
2. 然后用温的去污剂溶液洗涤玻璃板和间隔片,用自来水彻底冲洗,再用去离于水洗净。用乙醇冲洗玻璃板去掉水印,并放于一旁晾干。
必须小心翼翼地洗净玻璃板. 以确保灌胶时不会产生气泡。
3. 小块玻璃板的内面用聚硅氧烷溶液处理。在化学通风橱内将玻璃板放在一叠纸巾上, 内表面向上,在上面倾倒少量硅烷化液。用几张 Kimwipes 纸在玻璃板表面将硅烷化液涂布均匀,让玻璃板风干(l~2 min)。然后用去离子水洗,再用乙醇洗,风干。
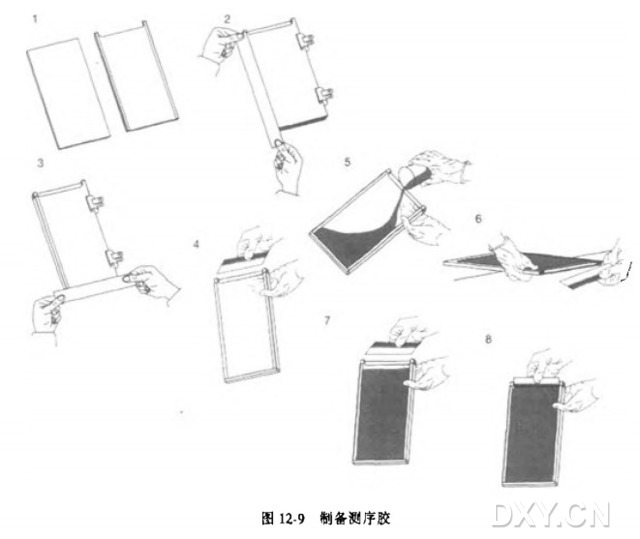
4. 把大块玻璃板(干净面朝上)放在空的试管架上,把隔片放在玻璃板的两边(见图12-9)。
如果用边沿窄的隔片,把厚的一边放在板的底部。在大板和隔片之间加入小滴凡士林使隔片在下一步时不会移动。
5. 再将较小(或带凹口)的玻璃板在间隔片上放置妥当,对齐隔片。
6. 用若干个大弹簧夹(长 5 cm) 将玻璃板的一边夹起来。
在玻璃板另一边及玻璃板底部贴上凝胶密封带,形成不透水密封,必须特别注意玻璃板的底角,因为这是最容易发生渗漏的地方。
7. 将弹簧夹换到已封好的一边,在玻璃板的另一边贴上凝胶密封带。
8. 将梳子放在胶模的敞开端并检査是杏贴切适合,取出梳子将空胶模放在实验桌上。
配胶
9. 在实验桌的工作区上铺上衬塑料的保护纸。
灌制测序凝胶时几乎不可能避免将丙烯酰胺溶液滴于桌面。
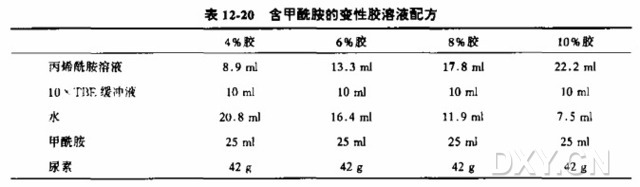
10. 在一个 250 ml 有臂锥形瓶中配制适当浓度的丙烯酰胺溶液(表 12-19)。这些溶液足够配制一块 40 cmx40 cm 的测序凝胶。
注意:凝胶的配制必须一气呵成,中间不能断断续续。
11. 混合所有试剂,在 55°C 水浴中加热 3 min 帮助尿素溶解。
溶解尿素的过程十分缓慢,必须依靠外部的热量。大约的体积是 66 ml, 加水到 100 ml。
12. 从水浴中取出溶液,冷却 15 min 至室温。不断搅拌混合物。
13. 把烧瓶放在真空装置里抽去气体。
防止聚合时产生气泡。
14. 把溶液放入 250 ml 玻璃烧杯中。加 3.3 ml 新制的 16% 的过硫酸铵,混匀。
旧的硫酸铵没有足够的聚合能力,会产生模糊的条带。

15. 加 50ulTEMED,轻轻旋动容器以混匀溶液。直接配胶。或者用 60cc 注射器吸取上述溶液约 40 ml。注意,不要有气泡。
与蛋白电泳相比,已经使用了最大量的 TEMED,确保了聚合足够快和足够均匀。聚合速度与时间有关, 温度越低聚合越慢。有经验的人利甩预冷却的方法可以用一次配制的混合物制成多块 40 cmx40 cm 胶。
从此步开始,动作尽可能迅速。
16. 用手托住胶模使之与水平面大约成 45°角,沿一边从移液管中缓缓灌入溶液(参见图 12-9)。

17. 将模子放在试管架上(见图 12-9)。
这一位置减少了模子底部的水压,防止漏胶。
18. 立即将鲨鱼齿梳子的平整侧插入凝胶液约 0.5 cm 处,梳子两端插人液面的深度应当等同,以便使凝胶垂直放置时梳子的平整表面能够保持水平。
如果梳子旁边可见气泡,慢慢取出梳于。洗净梳子表面,重新插入胶中。
19. 用弹簧夹夹住梳子使之就位。将剩余的丙烯酰胺-尿素溶液沿凝胶顶部加入,形成一串丙烯酰胺液滴。让凝胶在室温下聚合 15 min。
20. 冲洗 60cc 注射器以免被聚合的丙烯酰胺所堵塞。
警告:冲洗时将释放出少量未聚合的丙烯酰胺,应戴手套。
21. 聚合 15 min 后对凝胶进行检査,观察是否恰恰在梳子平整表面之下出现一道折射率不同的 Schlieren 线,这道线是聚合理想的标志。聚合完毕后(大约 1 小时),取下弹簧夹。
警告:冲洗时将释放出少量未聚合的丙烯酰胺,应戴手套。
22. 聚合完毕后,凝胶可立即使用(见方案 11),或保存于室温达 24 小时,或保存于4°C 48 小时。为防止保存期间发生脱水,可将梳子留于凝胶内并在凝胶顶部围放一些用 1XTBE 湿润的纸巾,纸巾可用 Saran 包装膜覆盖。在这一阶段不要拔掉梳子。

缓冲液和溶液
参照附录 1 配制贮存液、缓冲液、试剂。稀释贮存液到适当的浓度。
丙烯酰胺溶液(45%m/V)
丙烯酰胺(DNA 测序级) 434 g
N,N'-亚甲双丙烯酰胺 16 g
加水 至 600 ml
加热至 37°C 以促进溶解用蒸馏水调至 1 升,用硝酸纤维素膜过滤(孔径 0.45ptn). 室温贮存于棕色瓶中。另外一种较为昂贵的方法是购买预先混合好的丙烯酰胺: 双丙烯酰胺粉末,再用水溶解。便宜的丙烯酰胺: 双丙烯酰胺粉末通常混合有金属离子。由此配置的贮存液需要纯化,方法是,与 0.2体积的树脂(MB-1,Mallinckrodt) 混合搅拌,再用 Whatmenl 号纸过滤。贮存中,丙烯酰胺: 双丙烯酰胺会缓慢的变成酸性,这个脱氮基过程由光和碱催化。保持溶液 pH 值在7.0 或者以下,在黑色瓶中保存于室温应该每几周重配一次。
过硫酸铵水溶液(1.6%m/V)
去离子水
去污剂
乙醇
KOH/甲醇溶液
在 100ml 甲醇中加入 5 gK0 H 配成,用于清洗玻璃板,贮存在密闭的玻璃瓶中。
聚硅氧烷溶液
传统的聚硅氧烷溶液中包括二氯二甲基硅,它有毒性、挥发性并且易燃。近年来,出现了一些无毒的替代物,包括 Gel Slick(FMC Bioproducts)、RainX(Unelko,Scottsdale Arizona), 和 Acrylease(Stratagene)。
10XTBE 电泳缓冲液
TBE 在聚丙烯酰胺凝胶电泳时的浓度是 lx(89 mmol/L Tris-硼酸,2 mmol/L EDTA),这一浓度是琼脂糖电泳用量的 2 倍(请见第 5 章)。用于聚丙烯酰胺凝胶电泳的垂直电泳槽的缓冲液池一般较小,故所通过的电流量通常相当大。要用 lxTBE 才能够保证适当的缓冲容量。缓冲液的 pH 值应接近8.3。一般无须调 pH 值;可是,对于每次新配的 10XTBE 电泳缓冲液都要认真检査 pH 值。
使用同样的 10xTBE 电泳缓冲液配制胶和工作缓冲液,因为两者之间微小的差异也会导致 DNA迁移时严重扭曲。
使用氨基乙磺酸(36 g/L 的 10XTTE 缓冲液) 取代标准 TBE 溶液中的硼酸可以减少由于形成甘油-硼酸阴离子脂类化合物而导致的在胶的顶部的条带扭曲<Pisa-Willanson and Fuller1992)。若需要更多的信息请参见 DNA 测序反应中的甘油一节。
TEMED(N,N,N',N'-四甲基乙二胺)
电泳级的 TEMED 在很多公司有售(Sigma,Bio-Rad),TEMED 容易吸潮,必须 4°C 贮存在密闭的瓶中。它是聚合反应中的连接催化剂。
尿素,固体
特殊装置
弹簧夹:5 cm 长,每块胶 5 到 7 个。
干胶架
虽然不重要,干胶架对于干燥和贮存测序用的玻璃平板是非常方便的(Bio Whitraker)。
封胶带
例如 3M Scotch Stretchable Tape(Lab Safety Supply,Janesville,Wisconsin),3M Scotch yellow electrical tape#56(Life Technologies),3M Scotch polytetrafluorethylene(PFTE)extruded film tape。关于不同种胶带的用法和其他封胶的方法,参见 Hengen(1996)。
胶板(配对的) 和隔板
制胶的板一块比另一块略长 3.5-4.0 cm, 或者有一块板是缺刻的。为避免胶板裂了或者漏了,最好保持板是配对的并且和测序胶的槽相对应。
手套
无滑石粉、易处理的橡胶或者聚氯乙烯(PVC)。
凡士林
可选择,见步骤 4
保护性的工作合纸
一面是塑料的(Kaydry Lab Cover from Fisher) 或者 Benchkote。
鲨鱼齿梳子
0.4 mm 厚,32,64 或 96 齿. 依赖电泳装置的能力。
有臂的烧瓶(250 ml)
隔板(厚度一致或者边缘较窄)
每胶两板,由有弹性的薄塑料板(0.4 mm) 或特氟隆(Sanger and Coulson 1978) 制成,使玻璃板隔开。在胶板和隔板之间形成不透水的封口,使未凝固的胶溶液不会漏出。
边缘窄的隔板用于制造底部比顶部厚的胶,使底部的条带比较窄并且整块胶的条带比较均匀。虽然它有这样的优点,但是比较难以制备和干燥。
注射器(60cc)
可选择,见步骤 15.
试管架
55°C 水浴
方法
重要:为防止皮肤油脂的污染. 必须一直带无滑石粉的手套,并且只能拿板的边沿。
准备胶板
1. 必要时,甩 KOH/甲醇清洗板上的旧污渍。
2. 然后用温的去污剂溶液洗涤玻璃板和间隔片,用自来水彻底冲洗,再用去离于水洗净。用乙醇冲洗玻璃板去掉水印,并放于一旁晾干。
必须小心翼翼地洗净玻璃板. 以确保灌胶时不会产生气泡。
3. 小块玻璃板的内面用聚硅氧烷溶液处理。在化学通风橱内将玻璃板放在一叠纸巾上, 内表面向上,在上面倾倒少量硅烷化液。用几张 Kimwipes 纸在玻璃板表面将硅烷化液涂布均匀,让玻璃板风干(l~2 min)。然后用去离子水洗,再用乙醇洗,风干。
4. 把大块玻璃板(干净面朝上)放在空的试管架上,把隔片放在玻璃板的两边(见图12-9)。
如果用边沿窄的隔片,把厚的一边放在板的底部。在大板和隔片之间加入小滴凡士林使隔片在下一步时不会移动。
5. 再将较小(或带凹口)的玻璃板在间隔片上放置妥当,对齐隔片。
6. 用若干个大弹簧夹(长 5 cm) 将玻璃板的一边夹起来。
在玻璃板另一边及玻璃板底部贴上凝胶密封带,形成不透水密封,必须特别注意玻璃板的底角,因为这是最容易发生渗漏的地方。
7. 将弹簧夹换到已封好的一边,在玻璃板的另一边贴上凝胶密封带。
8. 将梳子放在胶模的敞开端并检査是杏贴切适合,取出梳子将空胶模放在实验桌上。

配胶
9. 在实验桌的工作区上铺上衬塑料的保护纸。
灌制测序凝胶时几乎不可能避免将丙烯酰胺溶液滴于桌面。
10. 在一个 250 ml 有臂锥形瓶中配制适当浓度的丙烯酰胺溶液(表 12-19)。这些溶液足够配制一块 40 cmx40 cm 的测序凝胶。
注意:凝胶的配制必须一气呵成,中间不能断断续续。
11. 混合所有试剂,在 55°C 水浴中加热 3 min 帮助尿素溶解。
溶解尿素的过程十分缓慢,必须依靠外部的热量。大约的体积是 66 ml, 加水到 100 ml。
12. 从水浴中取出溶液,冷却 15 min 至室温。不断搅拌混合物。
13. 把烧瓶放在真空装置里抽去气体。
防止聚合时产生气泡。
14. 把溶液放入 250 ml 玻璃烧杯中。加 3.3 ml 新制的 16% 的过硫酸铵,混匀。
旧的硫酸铵没有足够的聚合能力,会产生模糊的条带。

15. 加 50ulTEMED,轻轻旋动容器以混匀溶液。直接配胶。或者用 60cc 注射器吸取上述溶液约 40 ml。注意,不要有气泡。
与蛋白电泳相比,已经使用了最大量的 TEMED,确保了聚合足够快和足够均匀。聚合速度与时间有关, 温度越低聚合越慢。有经验的人利甩预冷却的方法可以用一次配制的混合物制成多块 40 cmx40 cm 胶。
从此步开始,动作尽可能迅速。
16. 用手托住胶模使之与水平面大约成 45°角,沿一边从移液管中缓缓灌入溶液(参见图 12-9)。

17. 将模子放在试管架上(见图 12-9)。
这一位置减少了模子底部的水压,防止漏胶。
18. 立即将鲨鱼齿梳子的平整侧插入凝胶液约 0.5 cm 处,梳子两端插人液面的深度应当等同,以便使凝胶垂直放置时梳子的平整表面能够保持水平。
如果梳子旁边可见气泡,慢慢取出梳于。洗净梳子表面,重新插入胶中。
19. 用弹簧夹夹住梳子使之就位。将剩余的丙烯酰胺-尿素溶液沿凝胶顶部加入,形成一串丙烯酰胺液滴。让凝胶在室温下聚合 15 min。
20. 冲洗 60cc 注射器以免被聚合的丙烯酰胺所堵塞。
警告:冲洗时将释放出少量未聚合的丙烯酰胺,应戴手套。
21. 聚合 15 min 后对凝胶进行检査,观察是否恰恰在梳子平整表面之下出现一道折射率不同的 Schlieren 线,这道线是聚合理想的标志。聚合完毕后(大约 1 小时),取下弹簧夹。
警告:冲洗时将释放出少量未聚合的丙烯酰胺,应戴手套。
22. 聚合完毕后,凝胶可立即使用(见方案 11),或保存于室温达 24 小时,或保存于4°C 48 小时。为防止保存期间发生脱水,可将梳子留于凝胶内并在凝胶顶部围放一些用 1XTBE 湿润的纸巾,纸巾可用 Saran 包装膜覆盖。在这一阶段不要拔掉梳子。