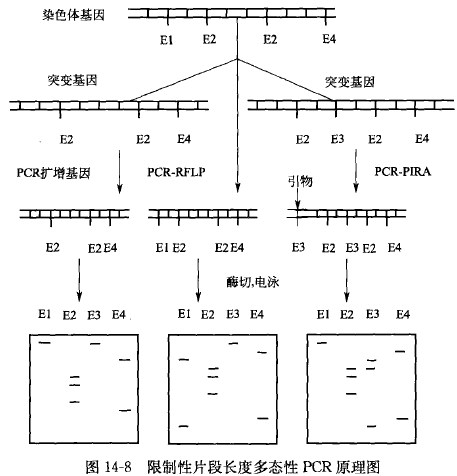
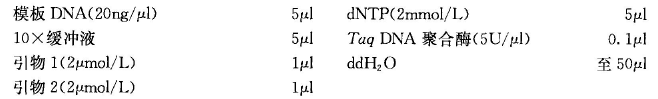限制性片段长度多态性 PCR
原理
限制性片段长度多态性 PCR(PCR-RFLP),首先利用 PCR 扩增目的基因,然后用限制性内切酶酶解样品 DNA,产生大量的限制性酶切片段,通过凝胶电泳分离不同大小的片段,可直接紫外观察,也可与克隆 DNA 探针进行 southern 杂交和放射显影。
DNA 限制性内切酶具有识别特定的 DNA 序列并在特定的部位切断 DNA 双链的活性功能,目标 DNA 分子由于突变(核苷酸的置换、插入或缺失)改变(或形成)了限制性内切酶识别序列,使 DNA 限制性内切酶不能(或可以)将靶 DNA 片段切断,最终导致酶切片段大小发生变化,从而检测出目标样品之间 DNA 分子水平的差异。
用途
可用于比较不同样品的 DNA 水平的差异,如多态性位点检测等,也被广泛应用于基因组遗传图谱构建、基因定位等。
材料与仪器
1.仪器:PCR 扩增仪 电泳仪 电泳槽 微波炉
2.试剂:模板 DNA、10xPCR 反应缓冲液、dNTP 溶液(包含四种 dNTPs,每种为 2.5mM)Taq 聚合酶及其缓冲液、PCR 引物、限制性内切酶及其缓冲液、DNA Ladder、琼脂糖、电泳缓冲液
步骤
一、PCR扩增
1.配制 PCR 反应体系,分为单酶切单一 DNA 样本和多酶切多个 DNA 样本
(1)单酶切单一 DNA 样本:以 20uL 终体系为例,将各组分混合于 200uL 的 PCR 离心管内,使各组分终浓度如下(冰上操作):1xPCR 缓冲液,0.2mM dNTP 溶液,上下游引物各1uM,1 U Taq聚合酶,10-50ng DNA,加 ddH2O 补足至 20uL;
(2)多酶切多个 DNA 样本:计算主反应混合物的总体积,即一个 DNA 样本所需的体积乘以 DNA 样本的数量,再加上额外的 10% 以弥补移液步骤中液体的损失;如若 PCR 产物需要被一种以上的限制性内切酶消化,则根据所用酶的数量成比例地增加总体积。以 10 种 DNA 模板为例,则需配制 220uL 终体系(额外加 10% 以弥补移液损失,即需配制11 个模板的终体系),将各组分混合于 1.5mL 的离心管内,使各组分终浓度如下,预先将模板DNA分别加入 PCR 管中(冰上操作),:1xPCR 缓冲液,0.2mM dNTP 溶液,,上下游引物各 1uM,1 U Taq 聚合酶,10-50ng DNA 共 n uL,加 ddH2O 补足至 220 uL;
(3)扩增程序:将配制好的 PCR 反应体系放入 PCR 仪,进行以下程序:95°C 5 min 后,进入循环程序:95°C 1min,根据引物设定的退火温度 1min,72°C 1min,30 个循环,最后 72°C 延伸5min,结束程序,4°C 保存。具体退火温度时间和延伸时间的设定可以根据具体情况做调整,基本原则与普通PCR一致。
(4)扩增产物检验:利用琼脂糖凝胶电泳先对 PCR 的产物大小、产率和非特异性背景进行测定,如若结果不理想,条带不清晰,则调整 PCR 条件后重新扩增,以免影响对酶切结果的分析判断。
二、PCR 扩增产物的酶切
配制酶切反应体系:消化 PCR 扩增的 DNA 的一般方法是直接在含有 PCR 产物的反应管中加入限制性内切酶。分为单一酶消化 PCR 产物或用多种酶消化 PCR 产物。
(1)单一酶消化 PCR 产物:
以单一酶消化单一 PCR 产物为例,配制 10uL 酶切反应终体系,将各组分混合于 200uL 的PCR 离心管内,使各组分终浓度如下(冰上操作):1 x酶切缓冲液,10U 限制性内切酶,,PCR 扩增产物 10ug,加 ddH2O 补足至 10uL,同时设立阳性对照组(将 PCR 扩增产物替换为已验证过有酶切位点并已知大小的纯化后的 DNA 片段,如质粒 DNA 经限制性内切酶扩增后有裂解位点的纯化 PCR 产物)
(2)多种酶消化 PCR 产物:
如若使用 n 种酶切单一 PCR 产物,则将以上单一酶消化 PCR 产物体系扩大成 n 份即可。
2.酶切:根据限制性内切酶的最适反应温度和时间设定,一般为过夜酶切,按照限制性内切酶说明书严格遵守。
三、 PCR 扩增产物的酶切
根据产物大小选择适合的琼脂糖凝胶浓度以及 DNA ladder 进行电泳。电泳结果可选择适合的燃料或者显影方式进行可视化记录。根据 DNA ladder 位置分析酶切片段的大小。
注意事项
1.靶片段的扩增产物要纯,如有非特异产物(特别是大片段可能含有酶识别序列)将竞争酶活性,使样品消化不完全或及出现酶消化杂带。
2.酶消化过程要充分(即底物与酶的比例要合适,消化时间要保证),避免假阴性结果。
3.酶切阳性结果可以确定所检测具体序列,阴性结果仅可说明非酶识别序列,但不能准确判定具体序列。
4.酶识别序列如有甲基化之核苷酸将不被切割。
5.要根据酶切结果选择适合浓度的琼脂糖凝胶浓度,如果酶切片段大部分小于 500bp,可选用聚丙烯酰胺凝胶电泳进行分离。
常见问题
1.如果观察不到酶切结果,可能是以下原因造成:限制内切酶反应效率低,序列内的核苷酸甲基化抑制限制性内切酶的识别,选用的限制酶在某些极端条件如高核酸内切酶浓度等可能被诱导星活性(在含有确定识别位点的其他位点剪切相似但不完全相同的序列,这种改变或放松的特异性被称为“星”活性,)。此时需要更换商品化效率高的限制性内切酶,或者提高 PCR 产物的纯度在一定程度上也可解决以上问题,同时需要确定 PCR 扩增中的其他干扰因素,如离子浓度等是否配比准确。
2.如果酶解产生的片段浓度较低,可用杂交的方式增加检测灵敏度。