限制性片段长度多态性PCR
简介
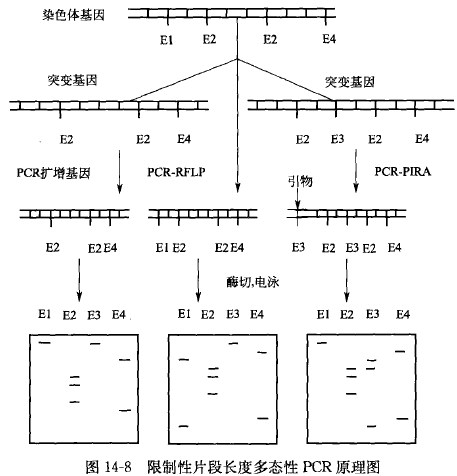
限制性片段长度多态性 PCR,是理论依据是首先利用 PCR 扩增目的基因,然后用限制性内切酶酶解样品 DNA,产生大量的限制性酶切片断。将限制性酶切产物进行含有漠化乙锭的琼脂糖凝胶电泳分离,在紫外灯下即可分辨各种限制性片段的大小及其位置。或者将限制性酶切产物与探针杂交进行放射自显影,从而区分各种片段。由于目标 DNA 之间存在有同源性和变异性,当用同一种限制性内切酶酶解不同品种或同一品种的不同个体时,不同酶切产物中就会含有相同或不同的长度片段,从而解读出目标样品之间在 DNA 分子水平的实际差异。
原理
限制性片段长度多态性 PCR 的基本原理,首先利用 PCR 扩增目的基因,然后用限制性 内切酶酶解样品 DNA,产生大量的限制性酶切片断。将限制性酶切产物进行含有漠化乙锭的琼脂糖凝胶电泳分离,在紫外灯下即可分辨各种限制性片段的大小及其位置。或者将限制性酶切产物与探针杂交进行放射自显影,从而区分各种片段。由于目标 DNA 之间存在有同源性和变异性,当用同一种限制性内切酶酶解不同品种或同一品种的不同个体时,不同酶切产物中就会含有相同或不同的长度片段,从而解读出目标样品之间在 DNA 分子水平的实际差异。
材料与仪器
器材:PCR 热循环仪、核酸电泳仪、凝胶成像设备、离心机等。
试剂:
① PCR 所用材料
DNA 模板提取试剂(针对不同的模板有不同的提取方式,因此应选择不同的试剂)、引物、Taq 酶、三磷酸脱氧核甘酸(dNTP)和反应缓冲液。
② RFLP 所用试剂
限制性内切酶及缓冲液、琼脂糖凝胶电泳试剂[琼脂糖、TBE 或 TAE 缓冲液、漠化乙锭(EB)]和聚丙烯酰胺凝胶电泳试剂 [丙烯酰胺:亚甲基双丙烯酰胺 = 29:1、TBE 缓冲液、上样液(0.25% 溴酚蓝,40% 蔗糖水溶液)、过硫酸铵、N,N,N',N'-四甲基乙二氨(TEMED)等]。
步骤
限制性片段长度多态性 PCR 的基本过程可分为如下几步:
1. 引物设计
根据选择的目标基因设计合适的扩增引物。
2. 制备模板 DNA
① 破碎细胞(动物、植物或微生物),离心取上清。
② 加入等体积的酚-氯仿-异戊醇(25:24:1), 充分混匀后 12 000 r/min 离心 10 min。
③ 取上清液加入二倍体积预冷的无水乙醇,轻轻摇匀,室温放置 5 min,12 000 r/min 离心 10 min。
④ 用 70% 预冷的乙醇洗涤一次,干燥,加入适量体积的 TE 缓冲液溶解,4 ℃ 保存。
3.PCR 反应扩增 DNA 反应体系:

PCR 反应条件:95 ℃ 样品变性 5 min, 进行 30 个循环反应(95 ℃ 变性 lmin、复性、72 ℃ 延伸),最后进行延伸反应。复性的温度和时间应根据具体情况而定,延伸的时间也要根据片段的长短而定。
4. 扩增产物的酶解
酶解反应体系:扩增产物 DNA(1 μg/μl)10 μl,酶切缓冲液(10 ×)2 μl,限制性内切酶(5 U/μl)2 μl,ddH2O 6 μl 终体积为 20 μl。
37 ℃ 酶切过夜。
5. 扩增产物的检测
(1)电泳:根据不同片段选择不同的凝胶电泳,如琼脂糖凝胶电泳(当片段)500 bp 时),或聚丙烯酰胺凝胶电泳(当片段 < 500 bp 时)。
(2)染色:用 0.2 mg/L 的漠化乙锭染色 20 min,紫外灯下检测结果,照相。
6.PCR-RFLP 结果的分析
PCR-RFLP 经凝胶电泳后,不同的样品可以分离出几条乃至十几条大小不同的条带,根据样品之间条带大小和所处的位置,就可以判别两个样品之间亲缘关系的远近及差异,也可以了解所扩增的基因在不同的物种中的保守区和易变区。通过设定表示亲缘关系远近的定值(如 60%), 当样品之间的相似度在此定值之上,可将它们列为同一物种。
注意事项
① 在 PCR 的引物设计时,尽量选择基因两侧的保守区,这样可以减少因引物设计而引起的扩增难度。
② 在 PCR 扩增时,Mg2+ 对 Taq 酶的活性影响较大,从而直接影响扩增效率的高低。反应混合液中的 EDTA、磷酸根均会影响 Mg2+ 的有效浓度。因此,应先在不同的 MgCl2 浓度下扩增 DNA,选择理想的酶离子浓度,选择范围一般在 0~4 mmol/L。
③ 二甲基亚砜(DMSO)是一种 PCR 促进剂,可以降低在 PCR 过程中 Taq 旳酶的用量,降低对扩增引物的要求和增加 PCR 产物的量。因此在确定了 MgCl2 浓度的条件之后,可以考虑使用 DMSO,但应选择合适的 DMSO 浓度,选择的范围一般在 5%~20%。
④ 限制性内切酶在适宜的反应条件下会完全按照它本身固有的性质在特异性碱基序列上切断 DNA 片段。但反应体系的 pH 值和反应温度等发生改变,以及所提取的 DNA 含有乙醇等,均会改变限制性内切酶的酶解反应特性,从而产生非特异性酶解 DNA 片段,这种现象称为酶的星号活性现象。该现象将影响对目的基因的判定,造成假阳性。在导致星号活性的因素当中,反应液中的甘油浓度、乙醇浓度、被酶解的 DNA 的质量和浓度最为重要。
⑤ 完全酶解是 PCR-RFLP 中的重要一步,若酶切不完全,虽对常见基因型的判断影响不大,但对稀有变异的个体会造成误检或漏检,并增加结果判定的难度,失去 RFLP 方法的优势。因此在酶解过程中,不同的酶解时间对于结果的判定会产生影响。一般情况下 37 ℃ 2~3 h 就可以酶解完产物,但在 PCR-RFLP 分析中宜采用酶解 4 h 或过夜。
⑥ RFLP 酶解片段在进行电泳分离的过程中,要根据片段的大小选择不同的琼脂糖浓度。因酶切可能产生小于 100 bp 的片段,所以琼脂糖的浓度应比一般电泳时的浓度高,大约在 2%~5% 范围内。如果产生的片段大部分小于 500 bp,可用聚丙烯酰胺凝胶电泳进行分离。如果酶解产生的片段浓度较低,可用杂交的方式来增加检测的灵敏度。
相关文章
- PCR-SSCP的发展现状
- PCR-SSCP注意的事项
- PCR-SSCP原理和操作步骤
- 内切酶在PCR反应产物中的活性(Activity of Restriction Enzymes in a Primer Extensio
- RT-PCR Analysis--详细的RT-PCR方法
- RT-PCR: The Basics
- Real-Time or Kinetic PCR
- PCR Amplification from Microbial Colonies
- Calculating Concentrations for PCR
- PURIFICATION OF PCR PRODUCTS WITH SEPHAD




